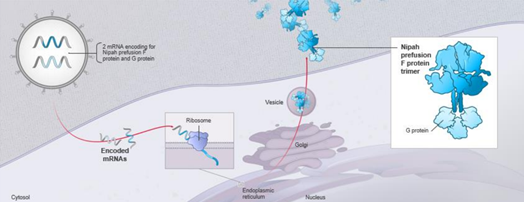
우선순위 병원체
치쿤구니야 바이러스
개요
- 치쿤구니야 바이러스는 대표적인 자연숙주로 이집트 숲모기
Aedes
aegypti 또는 흰줄 숲모기 Aedes albopictus가 있으며,
치쿤구니야 바이러스에 감염된 매개모기에 물려 감염이 전파됨
- 치쿤구니야 바이러스(Chikungunya virus,
CHIKV)는 Tokaviridae 과 Alphavirus 속에 속하는 외피로
둘러싸인 양성 단일가닥 RNA 바이러스로, 바이러스에 감염된 매개성 모기에 물려 인수공통 열성 질환인 치쿤구니야열을 일으키는
생물안전 3등급의 치명적인 병원체 중 하나임
- 치쿤구니야열은 무증상과 가벼운 두통 및 발열, 발진에서부터
염증성 관절통, 신경병증 통증과 같은 심각한 증상까지 다양하게 나타나며, 만성으로 진행되면 수년간 지속적인 다발성 관절통이 나타날
수 있음
- 치쿤구니야 바이러스는 1953년에 아프리카 중동부 지역의
Tanganyika 마을에서 처음으로 확인되었으며, 이후 아시아 등지, 중남미, 아메리카 등 다양한 지역에서 환자가 발생하고
있으며, 전 세계로 확산되고 있음
- 현재 치쿤구니야에 효과적인 치료제 및 백신이 존재하지 않아,
높은 주의가 필요한 치명적인 바이러스 중 하나임
치쿤구니야열(Chikungunya
Fever)과 치쿤구니야 바이러스(Chikungunya virus)
| 정의 |
치쿤구니야
바이러스(Chikungunya virus) 감염에 의한 급성 열성 질환 |
| 질병분류 |
제3급
감염병(질병코드: A92.0) |
| 병원체 |
토가바이러스과(Tokaviridae)
알파바이러스속(Alphavirus)
치쿤구니야 바이러스(Chikungunya virus)
(양성 단일가닥 RNA 바이러스)
|
|
| 주요 백신항원
|
Chikungunya structural polyprotein (C, E3, E2,
6k, E1) |
| 병원소 |
숲모기류 (흰줄
숲모기 Aedes
albopictus or 이집트 숲모기 Aedes
aegypti) |
| 감염경로 |
숲모기 ->
사람 |
치쿤구니야
바이러스에 감염된 매개모기에 물려 감염이 전파 (사람-모기-사람으로 전파), 수혈,
장기이식, 주사기 자상 등 혈액을 통한 전파 가능성 추정, 수직감염 사례 보고됨
|
| 국내발생 |
최근 5년간
2018년 3건, 2019년 16건, 2020년 1건, 2022년 6건(잠정) 발생함
|
| 국외발생 |
최초보고 |
1952년 아프리카
탄지니아 마콘데 고원에서 첫 유행이 있었고 당시 환자의 혈청에서 치쿤구니야 바이러스를
처음으로 분리하였으며, 이후 사하라 이남 아프리카에서 유행함 |
| 발생동향 |
(1963~2005년) 인도에서 14만 명 이상의 환자 발생
(2006~2007년) 아프리카, 아시아, 이탈리아 지역 환자 발생
(2009년) 인도네시아, 태국, 말레이시아에서 유행 보고
(2013년~) 캐리비안 지역, 북아메리카, 남아메리카 지역으로 확산
(2020년) 파키스탄, 인도, 브라질, 카리브해 지역에서 다수 보고
|
| 위험지역 |
아프리카 및 아시아
지역에서 주로 풍토적으로 발생하며, 특히 인도양 주변 국가 및 남동 아시아 지역이
위험지역으로 꼽히고 있음 |
| 해외유입 |
다수의 해외 유입
사례가 발생하였으며 특히, 동남아시아 방문 후 감염된 사례가 가장 많았음 |
| 잠복기 |
1~12일(평균
3~7일) |
| 임상 증상 |
-
감염된 환자의 약 3~28% 정도는 무증상 감염이며, 급성 증상은 대개
5~10일 정도가 되면 소실되고 증상이 경미하여 감염을 인식하지 못하거나
오진될 수 있음
- 주요
증상으로는 급성 발열, 관절통 등이며 그 외에도 두통 근육통, 관절 부종
또는 발진이 있음
-
(발열) 24~48시간 동안 지속되며 오한을 동반할 수 있음
-
(관절통) 열없이 나타날 수 있으며 아침에 악화되는 경향이 있고 가벼운
운동 시 완화되며 손과 발에 대칭적 발생 2~3일 동안 완화되었다가 다시
나타날 수 있음
-
(발진) 발열 발생 후 나타나며 몸통과 사지에 나타나지만, 손바닥,
발바닥, 얼굴에는 나타나지 않음
-
심근염, 뇌수막염, 길랑-바레 증후군, 뇌신경 마비, 눈 질환(포도막염,
망막염)과 골수염, 간염, 급성 신질환 등 중증 합병증을 일으킬 수 있음
|
| 치명률 |
사망률은 극히
낮으며 주로 고령에서 발생함 |
| 진단 |
검체(혈액, 체액
등)에서 특이 유전자 검출(Real-time RT-PCR) |
| 치료 |
전 세계적으로
상용화된 특이 치료제 없음, 증상에 따른 대증치료가 최선 |
| 예방 |
- 전
세계적으로 상용화된 예방 백신이 없으며, 유행지역 여행 시 모기에 물리지
않는 것이 가장 중요함(모기 기피제, 긴소매 옷 등)
|
※
출처 : 제3급 치쿤구니야열, 부산광역시 감염병관리지원단, 2023., 2023년도 바이러스성 모기매개감염병
관리지침, 질병관리청, 2023. 아이피온 재구성.
국내외 개발주체 동향
1
치쿤구니야 바이러스 백신 및 치료제 개발 동향
치쿤구니야 바이러스 감염증의 백신 후보군
- 현재 치쿤구니야의 승인된 치료제 및 백신은 존재하지 않으며,
임상시험이 실시되고 있는 치쿤구니야 백신에는 대표적으로 VLA1553, BBV87, MV-CHIK-202, PXVX0317,
VAL-181388, CHIK001, mRNA-1944 등이 있음
- 개발 중인 치쿤구니야 백신 중에서 FDA 승인이 유력한
백신으로 프랑스의 백신 전문 생명공학 회사인 발네바의 VLA1553 백신이 있음
치쿤구니야 바이러스 감염증의 백신 후보군
- 현재 치쿤구니야의 승인된 치료제 및 백신은 존재하지 않으며,
임상시험이 실시되고 있는 치쿤구니야 백신에는 대표적으로 VLA1553, BBV87, MV-CHIK-202, PXVX0317,
VAL-181388, CHIK001, mRNA-1944 등이 있음
- 개발 중인 치쿤구니야 백신 중에서 FDA 승인이 유력한
백신으로 프랑스의 백신 전문 생명공학 회사인 발네바의 VLA1553 백신이 있음
2
치쿤구니야 바이러스 감염증의 동물모델
치쿤구니야 바이러스 동물모델의 종류
- 치쿤구니야 바이러스의 백신 및 치료제 개발을 위해 비임상
실험에서 활용되는 대표적인 동물모델에는 마우스, 원숭이(영장류)가 있음
- 최근 치쿤구니야 감염 모델로 적합한 동물모델이 개발되고
있으며, 이러한 동물모델 중에서는 일부 유전적 변형을 통해 치쿤구니야 바이러스의 임상적 징후와 유사한 양상을 띠게 유도한 경우가
상당수 있음
- 동물모델들은 각각 장·단점이 분명하게 존재하나, 그중에서도
치쿤구니야 바이러스의 영장류 모델로 가장 대표적인 Cynomolgus macaques, Rhesus macaques 원숭이를
활용한 비임상 실험은 그 실험적 가치가 매우 높음
- 그 이유는 영장류가 인간과 가장 유사한 생리·면역학적 특성을
보이기 때문임
해외
1
임상시험 진행 중인 개발주체
Valneva Austria Gmbh
- Valneva Austria Gmbh는 감염병 예방 백신의
개발, 제조 및 상용화에 주력하고 있는 백신 전문 기업임
- Valneva는 치쿤구니야와 같은 의학적 미충족 수요가 큰
감염병 백신 개발에 중점을 두고 백신 개발에 있어 고도로 전문적이고 표적화된 방식을 취하고 있음
- Valneva의 치쿤구니야 백신 개발 프로그램은 앞서
2018년과 2021년에 각각 FDA 패스트 트랙(Fast Track)과 혁신적인 치료제(Breakthrough
Therapy)로서 지정받았으며, VLA1553은 2020년에 EMA로부터 PRiority MEdicine(PRIME) 지정을
받음
- 특히, Valneva에서 연구개발하고 있는
live-attenuated chikungunya 백신 ‘VLA1553’은 다수의 임상 시험에서 백신 효능에 대한 긍정적인 결과를
나타내고 있어 현재 선두를 달리고 있는 치쿤구니야 백신 후보로 평가됨
- VLA1553 백신은 치쿤구니야 바이러스의 비구조 단백질 중
하나인 nsP3의 일부 서열을 제거하여 약독화된 CHIKV LR2006 OPY1 감염성 클론을 기반으로 한 생약독화 백신임
- 최신 소식에 따르면, 미국 식품의약국(FDA)이 발네바의
치쿤구니야 백신 허가를 3개월 연기(11월) 한다고 밝혔으나, 늦어도 올해 안에 BLA(생물학적제제 허가신청) 승인을 받은 후
출시할 예정이기에 우선심사를 받을 수 있을 것으로 예상됨
- 따라서, VLA1553 백신은 치쿤구니야열 질환에 대한 패스트
트랙으로 승인되는 최초의 백신이 될 것으로 큰 기대를 모으고 있음
- VLA1553 백신은 현재 다수의 임상 1, 3 단계
임상평가를 진행 및 완료함 (NCT04786444 등 임상시험 현황 참고)
- Title : Study to Demonstrate
Consistency of Three Lots of a Live-attenuated Chikungunya Virus
Vaccine Candidate in Healthy Adults
- Collaborator: Themis
Bioscience GmbH
Themis Bioscience GmbH
- Themis Bioscience는 암과 전염병에 대한 면역조절
요법을 개발하고 있는 오스트리아의 백신 개발 제약사임
- Themis는 인체 면역 시스템 메커니즘에 대한 통찰력으로
백신의 발견, 개발 및 생산뿐만 아니라 면역 시스템의 활성화 기전과 관련된 정교하고 다양한 기술 플랫폼을 구축함
- 특히, 세계 최고의 유럽 백신 연구기관인 Institute
Pasteur의 과학자들이 개발한 벡터를 기반으로 Themis는 홍역 바이러스 벡터 플랫폼을 개발하였으며, 광범위한 백신 후보 및
면역조절 요법 파이프라인을 보유하고 있음. 2020년에 미국의 거대 제약사 Merck에 인수합병됨
- Themis Bioscience에서 개발한 치쿤구니야 바이러스
백신은 홍역 바이러스(measles virsu) 벡터를 기반으로 한 재조합 약독화 바이러스 벡터‘MV-CHIKV’백신으로, 해당
백신은 CHIKV Schwartz 균주의 pTM-MVSchw-CE3E26KE1(C-E3-E2-6K-E1)를 발현하는 재조합 홍역
바이러스 기반 치쿤구니야 백신임
- Themis는 재조합 약독화 바이러스 벡터 MV-CHIKV
백신의 상용화를 위해 독자적으로 임상시험을 진행하고 있음
- MV-CHIKV 백신은 현재 2단계 임상평가
완료(NCT02861586)
- Title : Phase II Study to
Evaluate Safety and Immunogenicity of a Chikungunya Vaccine
(MV-CHIK-202)
- Collaborator: Themis
Bioscience GmbH
Bavarian Nordic
- Bavarian Nordic는 감염성 질환 및 암 면역요법용
백신의 개발, 제조 및 상업화에 중점을 두고 있는 덴마크의 백신 전문 기업임
- 바이에른 노르딕에서 개발한 치쿤구니야 바이러스 백신은 바이러스
유사 입자(VLP) 백신으로 비리온과 유사하나 게놈 핵산을 포함하지 않는 자가 조립 구조의 단백질을 구성함
- 이러한 비리온 유사 단백질은 감염성이 없으나 숙주가 필요로
하는 면역원성을 얻기 위한 면역반응을 유발할 수 있음
- 해당 백신은 CHIKV West African
strain/37997 균주로서 치쿤구니야의 구조 단백질인 E1, E2, C 단백질을 발현하는 VLP 기반 치쿤구니야 백신임
- 현재 치쿤구니야 VLP
백신‘VRC-CHKVLP059-00VP/PXVX 0317’의 상용화를 위해 Bavarian Nordic은 다수의 임상시험을
Emergent BioSolution, NIAID와 함께 진행하고 있음
- VRC-CHKVLP059-00VP/PXVX0317 백신은 현재
다수의 임상평가 진행 및 완료(NCT05072080 등 임상시험 현황 참고 바람.)
- Title : A Phase 3 Trial of the
VLP-Based Chikungunya Vaccine PXVX0317
- Collaborator: Emergent
BioSolution
BHARAT BIOTECH
- BHARAT BIOTECH는 세계적 수준의 R&D 및
제조역량으로 유명한 선구적인 인도의 다국적 생명공학 회사임
- 바라트 바이오텍은 개발도상국에서 감염병을 극복하기 위해
저렴하고 안전하며 고품질의 백신과 치료제를 공급하는 것을 최우선 목표로 하고 있음
- 바라트 바이오텍의 감염병 관련 주요 연구 포트폴리오에
치쿤구니야, 로타바이러스, 말라리아 및 황생포도상구균 등에 대한 백신 개발이 포함되어 있음
- 지난 2020년에 CEPI(Coalition for
Epidemic Preparedness Innovations)는 바라트 바이오텍과 국제백신연구소 컨소시엄에 치쿤구니야 백신 개발을
가속화하기 위한 협약을 체결하고 자금을 지원함
- 이에 더해 컨소시엄은 인도 정부의 CEPI 협력사업인
Ind-CEPI 프로그램을 통해 추가 연구비를 지원받게 되며, 이는 인도에서 백신 연구를 위한 GMP 제조시설의 구축과 그에 따른
임상시험용 백신의 제조에 사용될 예정임
- 또한, 백신 제조 지원 이외에도 이번 협력으로
IVI(International Vaccine Institute)가 콜롬비아, 파나마, 태국에서 수행하는 복수
거점(multi-centre) 임상 2/3상 시험에 연구비를 지원하여 백신 후보물질의 안전성과 면역원성을 검증하고 있음
- 현재, 임상시험 중인 바라트 바이오텍의 치쿤구니야
백신은‘BBV87’백신이며, 해당 백신은 치쿤구니야 ECSA(East/Central/South African) 균주의
inactivated whole virus 백신임
- 현재 치쿤구니야‘BBV87’백신의 상용화를 위해 CEPI의
지원과 더불어 BHARAT BIOTECH, IVI는 2건의 임상시험을 진행하고 있음
- BBV87 백신은 현재 2건의 임상평가 완료 및 모집 중
- Title : Clinical Trial to
Evaluate the Immunogenicity of Chikungunya Vaccine, Seamless
Controlled Trial To Evaluate Safety And Immuno genicity of Chikun
gunya Vaccine in LatinAmerica and Asia (IVI-CHIK-001) (NCT04603131,
NCT04566484 등 임상시험 현황 참고 바람.)
- Collaborator: No information
provided
2
주요 특허 개발주체
ModernaTX, Inc
- Moderna는 지난 2010년 창립한 생명공학 기업으로,
새로운 수준의 mRNA(messenger RNA) 의약품 개발을 선도하고 있음
- mRNA 플랫폼을 활용한 다양한 감염성 적응증에 대한 백신을
개발하고 있으며, 특히 수두 대상포진 바이러스 백신(mRNA 1278), 거대세포 바이러스 백신(mRNA 1443), 앱스타인바
바이러스 백신(mRNA 1195), 지카바이러스 백신(mRNA 1893), 치쿤구니야 바이러스 백신(mRNA-1944,
VAL-181388) 등을 개발하고 있음
- 모더나에서 개발 중인 치쿤구니야‘mRNA-1944’백신은
치쿤구니야 감염에 의해 생성된 환자의 B 세포에서 분리한 인간 IgG 항체 암호화 mRNA를 모더나의 독자적인
지질나노입자(LNP, Lipid nanoparticle)로 코팅한 백신으로 접종 시 치쿤구니야 감염으로부터 숙주를 보호함
- 또한, 모더나에서 개발 중인 다른 치쿤구니야
백신‘mRNA-1388’은 치쿤구니야 바이러스의 구조 다단백질 C-E3-E2-6K-E1 암호화하는 단일 mRNA를 지질나노입자로
둘러싼 형태의 백신으로 접종 시 체내에서 가공되어 VLP로 조립 후 면역원성 획득을 위한 항원으로 작용함
- 모더나는 mRNA 플랫폼을 활용한 치쿤구니야 백신 관련 특허를
출원하여 주요 출원인으로서 활발하게 연구를 진행하고 있음
Institut Pasteur
- Institut Pasteur는 생물학, 미생물학, 질병 및
백신 연구에 전념하고 있는 프랑스의 비영리 연구 재단임
- 100년이 넘는 기간 동안 다양한 전염병(에이즈, 디프테리아,
결핵, 소아마비, 인플루엔자, 황열병, 치쿤구니야 등)의 위협에 대응하기 위한 연구를 진행하고 있음
- 파스퇴르 연구소는 치쿤구니야 바이러스에 대한 연구 프로그램을
진행하고 있는데, 주요 연구 내용에는 치쿤구니야 바이러스의 변종 연구, 진단 방법, 질병 동물 모델 개발, 백신 후보군 설계 등이
있음
- 실제 파스퇴르 연구소의 과학자들은 재조합 홍역 벡터를 활용한
치쿤구니야 백신 관련 특허를 출원함
- 파스퇴르 연구소와 재조합 홍역 벡터 관련 특허의 공동 출원인인
Themis는 홍역 바이러스 벡터 플랫폼을 활용하여 홍역 바이러스(measles virus) 벡터 기반 재조합 약독화
바이러스인‘MV-CHIKV’치쿤구니야 백신을 개발함
- 현재 Themis Bioscience에서 상용화 개발을 위해
다수의 임상 2상 시험을 진행하고 있음
니파 바이러스
개요
- 니파 바이러스 (Nipah virus; NiV)는 Paramyxoviridae 과의
Henipavirus 속에 포함되는 RNA
바이러스로, 인수공통 니파 바이러스성 감염증을 일으키는 생물안전 4등급의 치명적인 병원체 중 하나임
- 니파 바이러스는 대표적인 자연숙주로 Pteropodidae 과의 Pteropus
속에 속하는 과일박쥐가 있으며, 감염된 박쥐의 소변이나 타액으로 오염된 대추야자 수액의 섭취 혹은 중간·증폭 숙주인 병든 돼지와의
접촉 및 섭취로 전염됨1)
- 니파 바이러스성 감염증은 급성 호흡기 감염에서부터 치명적인
뇌염에 이르기까지 다양한 임상적 증상을 유발함
- 니파 바이러스는 1998년 말레이시아 Kampung
Sungai Nipah 마을에서 처음으로 확인되었으며, 이후 방글라데시, 아시아 동남부, 인도, 싱가포르 등 매년 다양한 지역에서
꾸준히 환자가 발생하고 있음
- 현재 니파 바이러스 감염증 치료에 효과적인 치료제 및 백신이
존재하지 않아, 높은 주의가 필요한 전 세계에서 가장 치명적인 바이러스 중 하나임
- 1) Nipah virus: epidemiology,
pathology, immunobiology and advances in diagnosis, vaccine
designing and control strategies - a comprehensive review.
Veterinary Quarterly 2019.
니파바이러스감염증(Nipah
visus disease)과 니파 바이러스(Nipah virus)
| 정의 |
니파바이러스 감염에
의한 급성, 열성 및 바이러스성 인수공통 전염병2)
|
| WHO 질병분류
|
ICD-10
B33.8(기타 명시된 바이러스성 질환) |
| 병원체 |
파라믹소비리데과(Paramyxoviridae)
헤니파바이러스속(Henipavirus)
니파바이러스(NIpah virus)
(음성 단일가닥 RNA 바이러스)
|
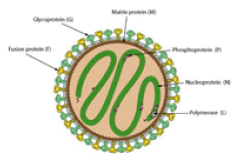
|
| 주요 백신항원
|
Nipah
virus glycoprotein (G, F) |
| 병원소 |
감염된
동물(Pteropodidae과 Pteropus속 과일박쥐, 돼지 등), 감염된 동물의
체액에 의해 오염된 식품, 직접 접촉한 환자 |
| 감염경로 |
바이러스에 감염된
자연계 병원소(과일박쥐, 돼지 등)와 직접 접촉, 환자 직접접촉 |
| 바이러스 감염
동물의 체액에 의해 오염된 식품(야자 수액 또는 과일 등) 소비 |
| 국내발생 |
국내 발생 없음
|
| 국외발생 |
최초보고 |
1998년
말레이시아에서 처음 확인됨 |
| 발생동향 |
1998-1999년
말레이시아 순가이 니파 마을에서 처음으로 발생하여 그 이후, 방글라데시, 인도,
필리핀, 싱가포르 등 니파벨트 지역에서 산발적인 발병이 발생함3)
|
| 위험지역 |
방글라데시, 인도,
말레이시아, 필리핀, 싱가포르 등이 있음 |
| 해외유입 |
국내 유입사례 없음
|
| 잠복기 |
약 4~14일
|
| 임상 증상 |
- 니파
바이러스 감염증의 일반적인 증상은 처음 3-14일에 발열과 두통이
나타나며 기침, 인후통, 호흡곤란과 같은 호흡기 질환의 징후를 포함함
- 뇌가
붓는 단계(뇌염)가 뒤따를 수 있으며, 이로 인한 증상으로는 졸림, 방향
감각 상실, 정신적 혼란을 포함할 수 있고, 24-48시간 내에
혼수상태로 빠르게 진행될 수 있음
-
(가벼운 증상) 열, 두통, 기침, 인후염, 호흡곤란, 구토 등
-
(심각한 증상) 방향감각상실, 졸음 또는 혼란, 발작, 코마,
뇌부종(뇌염)
|
| 치명률 |
40-70% (유행
지역의 감시 역량에 따라 상이) |
| 진단 |
검체(혈액, 체액
등)에서 특이 유전자 검출(Real-time RT-PCR) 및 바이러스 항원-항체 반응
검사 |
| 치료 |
전 세계적으로
상용화된 특이 치료제 없음, 보존적 치료 실시 유행시 항바이러스제
리바비린(Ribavirin) 사용 |
| 예방 |
- 전
세계적으로 상용화된 예방 백신이 없으며, 유행지역 여행 시 감염된
동물과의 접촉(박쥐, 돼지 등) 차단, 발생지역 내 대추야자 수액 섭취
금지, 사람간 감염 예방을 위한 기본수칙 준수 필요
|
※
출처 : 주간 국내외 감염병 동향, 질병관리본부, 2018., 2023 서울특별시 감염병 주간 소식, 서울특별시
시민건강국 감염병연구센터, 2023., 아이피온 재구성.
- 2) 주간 국내외 감염병 동향, 질병관리본부,
2018.
- 3) 2023 서울특별시 감염병 주간 소식,
서울특별시 시민건강국 감염병연구센터, 2023.
국내외 연구개발 동향
1
니파 바이러스 백신 및 치료제 개발 동향
니파 바이러스 감염증의 백신 후보군
- 니파 바이러스 감염을 예방하기 위해 백신 플랫폼인 생체조합
바이러스 벡터, 단백질 소단위 및 바이러스 유사입자(VLP) 등 다양한 플랫폼을 활용한 백신화 전략이 연구되고 있음
- 현재, 대부분의 백신 후보군들이 바이러스 벡터 및 단백질
서브유닛 백신 플랫폼을 활용하여 개발되고 있음
니파 바이러스 감염증의 치료제 후보군
- 현재, 니파 바이러스 감염증에 관한 효과적인 항바이러스제,
항체 및 백신은 존재하지 않기 때문에 높은 주의가 필요함
- 치료와 관련하여 가능한 경우, 중증 호흡기 및 신경학적
합병증에 대한 보조 요법이 현재 니파 바이러스 감염증의 치료 표준으로 활용되고 있음
2
니파 바이러스 감염증의 동물모델
니파 바이러스 동물모델의 종류
- 니파 바이러스는 과일박쥐, 고양이, 돼지 및 말을 포함하여
광범위한 야생 및 가축을 감염을 전파하며, 동물들의 증상은 그 종류에 따라 인간과 유사하지 않거나 가변적이어서 아무 동물이나 니파
바이러스 동물모델로 활용될 수 없음
- 현재, 대표적인 니파 바이러스 동물모델에는 시리아 골든
햄스터, 흰족제비, 아프리카 녹색 원숭이 등이 있고 해당 동물들은 인간에서 니파 바이러스 감염증의 증상과 병리를 가장 정확하게
나타내어 동물실험 모델로 활용되고 있음
해외
1
임상시험 진행 중인 개발주체
Auro Vaccines LLC
- Auro 백신은 감염성 질병에 대한 예방 및 치료 백신의
설계와 개발, 그리고 임상 단계 백신 개발 회사임
- Henry M. Jackson foundation의 허가를
받아 니파 바이러스(NiV) 감염 예방을 위해 헨드라(Hendra) 바이러스의 glycoprotein(G 단백질, 당 단백질)으로
구성된 재조합 서브유닛 백신(HeV-sG-V)의 임상 연구를 진행하고 있음
- HeV-sG-V Nipah vaccine 후보군은
NIAID(National Institutes of Allergy and Infectious Diseases; 미국 국립
알레르기·감염병 연구소)와 CEPI(the Coalition for Epidemic Preparedness Innovations;
전염병 예방혁신연합)의 지원으로 소동물에 대한 면역원성 및 효능 연구, IND 활성화 안전성 연구, cGMP 백신 제조 및 출시를
완료함
- 백신은 현재 1단계 임상평가 진행 중(NCT04199169)
- Title : Safety and
Immunogenicity of a Nipah Virus Vaccine
- Collaborator : PATH, Coalition
for Epidemic Preparedness Innovations, Cincinnati Children's
Hospital Medical Center (CCHMC)
Public Health Vaccines(PHV)
LLC
- PHV는 rVSV 기술 플랫폼을 보유하고 있는 비상장 생명공학
회사로, 다른 filovirus와 신변종 감염병 백신을 개발하고, 과거 rVSV 벡터 기반 Ebola Zaire vaccine
개발을 성공적으로 진행함
-
PHV, Crozet BioPharma와 공동으로 개발하고 있는 니파 바이러스 백신 PHV02(rVSV∆G-EBOV GP/NiV
G)은 수포성 구내염 바이러스(VSV) 벡터를 이용하여 1회 접종의 약독화 된 니파 바이러스 백신임
-
출처 : Nipah Vaccine
Target, The Nipah Vaccine Project
- rVSV-Nipah vaccine은 국립 보건원(NIH;
national institutes of health)의 일부인 국립 알레르기 및 전염병 연구소(National institute
of allergy and infectious diseases, NIAID)의 바이러스학 연구소(laboratory of
intramural research) 내 하인즈 펠드만 박사(Dr. Heinz Feldmann) 연구소에서 최초 개발됨
- PHV는 감염병 예방 혁신 연합(CEPI)과 최대 4,360만
달러 규모의 파트너 계약에 따라 2상 임상 테스트를 통해 백신 후보로 발전시키기 위해 자금을 지원받음
- PHV와 CEPI는 니파 백신 개발과 관련된 웹사이트를 개설
- 백신은 현재 1단계 임상평가 진행 중(NCT05178901)
- Title : A Phase 1 Study to
Evaluate Safety & Immunogenicity of rVSV-Nipah Virus Vaccine
Candidate PHV02 in Healthy Adult Subjects
- Collaborator : Coalition for
Epidemic Preparedness Innovations
모더나(Moderna)
- 모더나는 메신저 RNA 치료제 및 백신 개발에 주력하고 있는
생명 공학 회사로 2021년부터 mRNA 플랫폼 기술을 활용한 인플루엔자, HIV 그리고 니파 바이러스를 예방할 수 있는 백신의
개발 목적을 드러냄
- 2022년 7월, 모더나는
국립알레르기전염병연구소(NIAID)와 함께 니파 바이러스 감염병을 예방하기 위한 연구용 백신을 평가하는 초기 단계 임상시험을
시작함
-
이번 실험용 백신은 매사추세츠 캠브리지에 있는 모더나에서 제조했으며 NIAID의 백신 연구센터와 공동으로 개발을 진행함
-
출처 : Moderna
Presentation, 2021.
- 본 임상실험에 사용된 mRNA-1215 백신은 NiV의
항원(F or G 당단백질)과 mRNA 플랫폼 기술을 활용한 백신임
- 이번 임상실험을 통해 백신의 안전성, 내약성 및 면역반응을
생성하는 능력을 평가할 예정임
- 백신은 현재 1단계 임상평가 진행 중(NCT05398796)
- Title : Dose Escalation,
Open-Label Clinical Trial to Evaluate Safety, Tolerability and
Immunogenicity of a Nipah Virus (NiV) mRNA Vaccine, mRNA-1215, in
Healthy Adults
- Collaborator : Moderna TX,
Inc, National Institute of Allergy and Infectious Diseases (NIAID)
2
주요 특허 개발주체
Henry M. Jackson Foundation
- HJF(Henry M. Jackson Foundation)은
군사 의료 연구 발전에 전념하고 있는 글로벌 비영리 기관으로 군대 구성원과 민간인 모두에게 혜택을 줄 수 있는 과학 프로그램을
관리 및 지원함으로써 군사, 의료, 학계 및 정부에게 서비스를 제공함
- HJF는 감염성 질병을 군의 임무 수행능력과 작전 준비 태세에
대한 가장 큰 위협 중 하나로 설정하고 있음
- 이는 감염성 질병이 경제, 군대, 정부를 약화시켜 국제 안정에
영향을 미칠 수 있다고 판단하기 때문이며, 공공-민간 파트너십을 촉진하고 새로운 대책을 개발하기 위한 연구 포트폴리오를 강화하고
있음
- 이러한 재단의 지원 및 관리로 군 의료 연구원 및 임상의는
과학적 목표 달성을 유지하고 연구목표를 효과적이고 효율적으로 달성할 수 있게 함
- 대표적인 HJF의 지원 사례로 USU Broder 실험실에서
개발한 HeV-sG-V 백신의 기술이전이 있으며, USU-HJF 공동 기술이전 사무소를 통해 해당 기술이 Auro Vaccines
LLC에 라이선스 되었음
- 현재 해당 백신은 2020년 3월부터
CEPI(Coalition for Epidemic Preparedness Innovations)의 지원을 받아 임상 1상 시험에
있음(앞서 HeV-sG-V와 동일)
- 또한 HJF는 감염성 질병 중 하나인 니파 바이러스와 관련된
연구를 진행하고 있으며, 다수의 특허도 보유하고 있어 활발히 연구를 이어가고 있음
Zoetis Services LLC
- Zoetis는 애완동물과 가축을 위한 미국의 의약품 및 백신을
생산하는 세계 최대 동물의약품 제약사임
- 본래 세계 최대 제약회사인 화이자(Pfizer)의
자회사였지만, 화이자가 회사의 지분 83%를 분사하면서 완전히 독립된 회사가 됨
-
세계 동물의약품 분야 1위 회사로 300개 이상의 제품 포트폴리오를 보유하고 있으며, 2018년 아박시스(Abaxis)를 인수하며
동물 건강진단 사업에 진출하여 예측-예방-진단-치료에 이르기까지 동물 건강 밸류체인을 구축함
- 조에티스는 말과 인간에게 매우 치명적인 감염과 관련된 박쥐
매개 헨드라 바이러스 백신을 2012년 11월에 개발함
- 해당 백신은 말에게만 사용할 수 있는 헨드라 바이러스 중화
서브유닛 백신으로, 바이러스에 대한 가용성 형태의 G 표면 항원으로 구성되어 있음
- 조에티스는 이외에도 각종 가축용 세균성 질병에 대한 치료제,
전염성이 큰 다양한 질병 예방용 백신, 바이러스 백신 등 포트폴리오를 다양화하고 있음
- 현재, 조에티스는 위의 가축용 니파 바이러스 백신 기술과
다수의 니파 바이러스 관련 특허를 보유하고 있음
큐어백(Curevac)
- CureVac은 메신저 RNA를 기반으로 한 치료법을 개발하는
독일의 바이오 제약회사이며, 주로 세 가지 치료 영역인 감염병 예방 백신, 암 면역 요법 및 분자 요법에 초점을 두고 mRNA
기반 파이프라인을 구축함
- CureVac의 파이프라인에는 mRNA 기반 전염병 예방
백신으로 Influenza, COVID-19, Rabies virus, Lassa, Yellow fever, Rotavirus,
Malaria, 기타(Nipah virus) 등 다양한 전염병 백신을 개발하고 있음
- 또한, mRNA를 이용한 니파 바이러스에 관한 특허도 보유하고
있음
국내
진원 생명과학
- 진원 생명과학은 지난 2021년 12월 미국 위스타
연구소(Wistar Institute of Anatomy x-x-and Biology)가 보유한 니파(Nipah) 및
포와산(Powassan) 바이러스를 예방하는 핵산 백신 후보물질의 기술이전 계약을 체결함
- 진원 생명과학이 보유한 핵산 백신 개발 플랫폼을 이용해 DNA
백신 및 mRNA 백신의 임상 개발뿐 아니라 니파 감염병이 확산 중인 동남아시아 백신 기업들과 라이선스 사업화를 기획함
- 이에 그치지 않고, 2023년 5월 진원 생명과학은 위스타
연구소와 니파 바이러스 예방 및 치료를 위한 저분자 화합물 신약 개발을 위한 공동연구를 선언함
- 진원 생명과학은 기존에 개발 중인 니파 바이러스 백신에 추가로
신규 모달리티(Modality)인 저분자 화합물 기반 항바이러스 치료제를 제품 포트폴리오 다각화의 일환으로서 연구개발에 착수함
버나젠(VERNAGEN)
- 에스티팜의 미국 자회사 버나젠은 최근, 미국
질병통제예방센터(CDC)와 하트랜드 바이러스(HRTV)에 대한 mRNA 백신 공동 연구개발 협약을 체결함
- 버나젠은 에스티팜의 mRNA 플랫폼 기술을 이용해 하트랜드
바이러스 mRNA 백신 후보물질을 발굴할 예정이며, 에스티팜은 위탁생산개발(CDMO)을 맡아 시료를 생산해 미국 질병청에 공급할
예정임
- 또한, 버나젠은 mRNA 기반 감염병 예방 백신 및 치료제
연구개발에 집중하고 있으며, 미국 질병청과의 공동연구 외에도 니파 바이러스, SFTSV, 수두대상포진바이러스(VZV),
호흡기세포융합바이러스(RSV) 등 다양한 감염병을 대상으로 mRNA 백신을 연구개발하고 있음
라싸 바이러스
개요
- 라싸 바이러스 (Lassa virus; LASV)는 Arenaviridae 과에 속하는 외피가
있고, 두 개의 분절로 나누어진 단일 가닥 RNA 바이러스로, 인수공통 급성 바이러스성 출혈성 질환인 라싸열을 일으키는 생물안전
4등급의 치명적인 병원체 중 하나임
- 라싸 바이러스는 대표적인 자연숙주로 서아프리카 지역에 서식하는
설치류인 Mastomys natalensis가 있으며, 감염된 설치류에 의한 오염된 음식, 물, 배설물, 중간숙주의 도살 및
섭취로 전파됨
- 라싸열은 무증상과 가벼운 두통 및 발열에서부터 각 신체 부위의
출혈과 같은 심각한 증상까지 다양하게 나타남
- 라싸 바이러스는 1969년 나이지리아 라싸 마을에서 처음으로
확인되었으며, 이후 서아프리카 일부 지역에서 정기적으로 발생하여 Benin, Ghana, Guinea, Liberia, Mali,
Nigeria, Sierra Leone, and Togo 등 다양한 지역에서 꾸준히 환자가 발생하고 있음
- 현재 라싸열에 효과적인 치료제 및 백신이 존재하지 않아, 높은
주의가 필요한 전 세계에서 가장 치명적인 바이러스 중 하나임
라싸열(Lassa
Fever)과 라싸 바이러스(Lassa virus)
| 정의 |
라싸
바이러스(Lassa virus) 감염에 의한 급성 발열성·출혈성 질환1)
|
| 질병분류 |
제1급
감염병(질병코드: A96.2) |
| 병원체 |
아레나바이러스과(Arenaviridae)
라싸 바이러스(Lassa virus)
(두 개의 분절로 나뉘어진 단일가닥 RNA virus)
|
|
| 주요 백신항원
|
Envelope
GPC(GP1, GP2) glycoprotein |
| 병원소 |
설치류 중
Mastomys
natalensis |
| 감염경로 |
동물 → 사람
|
감염된 설치류(쥐) 직간접적 접촉/설치류 배설물(소변, 대변) 흡입
(섭취) 쥐 또는 쥐 배설물에 오염된 음식물 섭취
(접촉) 토양으로 흡수된 쥐의 배설물에 상처 난 피부나 점막 노출
(흡입) 쥐배설물에 오염된 바닥 청소과정에서 발생한 에어로졸 흡입
|
| 사람 → 사람
|
라싸열 환자·사망자의 혈액, 체액 접촉
(접촉) 상처 난 피부 점막에 환자의 혈액, 체액 직접 접촉
(접촉) 감염된 환자와 성 접촉
(접촉·흡입) 의료 환경에서 의료행위, 시술 중 노출되어 감염 전파
|
| 국내발생 |
국내 발생 없음
|
| 국외발생 |
최초보고 |
1969년
나이지리아 Borno 주 Lassa 지역에서 발생 보고 |
| 발생동향 |
서아프리카 지역에서
건기(11월~5월)에 유행 발생 및 연중 산발적 발생 |
| 위험지역 |
베냉, 가나,
기니, 나이지리아, 라이베리아, 말리, 시에라리온, 부르키 나 파소, 코트디부아르,
토고 중앙아프리카공화국(그 외, 서아프리카 지역) |
| 해외유입 |
1969-2016년, 9개 국가에서 총 33건 (영국 13, 미국 8, 독일 5,
네덜란드 2, 캐나다 1, 이스라엘 1, 일본 1, 스웨덴 1, 남아프리카 1)
|
| 잠복기 |
2-21일 |
| 임상 증상 |
-
감염된 사람의 약 80%는 증상 경미하거나 무증상이며, 중증으로도 이환
가능2)
-
보통, 감염 후 6∼21일 사이에 증상 발현, 생존 시 8∼10일 내
호전
- 발열, 전신무력감, 권태감, 두통, 인후통으로 시작
- 수일 내 통증 반응, 소화기계, 호흡기계 증상 발현 가능
- 중증
이환 시, 안면부종, 출혈, 다발성 장기부전으로 사망에 이름
|
| 치명률 |
감염자의 약 1∼3%, 입원환자에서는 15-20%*
각국의 보건의료체계 수준에 따라 다름(’15-’16년 나이지리아 유행시 치명률
32.6%)
|
| 진단 |
검체(혈액, 체액
등)에서 특이 유전자 검출(Real-time RT-PCR) |
| 치료 |
전 세계적으로
상용화된 특이치료제 없음(대증치료) 다만, 증상 초기에 항바이러스제(리바비린) 투여 시
효과가 있는 것으로 알려져 있음 |
| 예방 |
- 전
세계적으로 상용화된 예방백신 없음
-
유행지역 여행 시 라싸열 바이러스에 감염되지 않도록 주의(개인·식품·환경
위생)
- 쥐/쥐 배설물에 노출되지 않도록 주의, 뚜껑 없이 개방된 음식물 섭취
삼가 등
-
의료환경에서 감염예방 수칙 준수 철저
- 모든 환자의 혈액, 체액 접촉 시 개인보호구 사용, 손 위생 등
표준주의 준수
- 감염 증상자(발열 등) 및 확인된 라싸열 환자의 혈액, 체액, 검체
취급 시 주의 등
|
※
출처 : 질병관리청, 제1급감염병 바이러스출혈열 대응지침, 2023, 제주감염병관리지원단(JeCI) 홈페이지,
아이피온 재구성
- 1) 질병관리청, 제1급감염병 바이러스출혈열
대응지침, 2023.
- 2) 제주감염관리지원단(JeCI) 홈페이지.
국내외 연구개발 동향
1
라싸 바이러스 백신 및 치료제 개발 동향
라싸 바이러스 감염증의 백신 후보군
- 개발되고 있는 라싸 바이러스의 주요 백신 플랫폼에는 DNA
백신, 바이러스 유사 입자 백신(VLP), 재조합 수포성 구내염 바이러스(VSV), 광견병, 홍역, 백시니아, 아데노바이러스 벡터
백신 등이 다양하게 활용되고 있음
- 현재, 라싸열 백신으로 임상시험 단계에 있는 백신 플랫폼에는
rVSV based, DNA based, MV-LASV 등이 있음3)4)
- 3) Understanding Immune
Responses to Lassa Virus Infection and to Its Candidate Vaccines,
Vaccines, 2022.
- 4) ClinicalTrials.gov(2023.8)
라싸 바이러스 감염증의 치료제 후보군
- 현재, 라싸열의 승인된 치료제 및 백신은 존재하지 않으나
치료제의 경우 라싸열 감염 후 조기 Ribavirin의 투여가 치료 효능을 보인다는 관찰 결과가 있으며, 추가적으로
Favipiravir(T-705) 등 다양한 약물이 연구되고 있음5)
- 라싸열 치료제로 임상시험 단계에 있는 약물은
Ribavirin, Favipiravir, ARN-75039 등이 있음
- 5) Lassa Virus Infection: a
Summary for Clinicians, ELSEVIER, 2022.
2
라싸 바이러스 감염증의 동물모델
라싸 바이러스 동물모델의 종류
- 라싸 바이러스의 백신 및 치료제 개발을 위해 비임상 실험에
활용되는 대표적인 동물모델에는 마우스, 기니피그, 원숭이(영장류)가 있음
- 최근 라싸 바이러스의 감염 모델로 적합한 동물모델이 개발되고
있으며, 이러한 동물모델 중에서는 일부 유전적 변형을 통해 라싸 바이러스의 임상적 징후와 유사한 양상을 띠게 유도한 경우가 상당수
있음
-
라싸 바이러스 동물모델
| 라싸 바이러스 동물모델
|
장점 |
단점 |
Murine Models
(Natalensis
mastomys, IFNAR-/-, Chimeric IFNAR-/-B6,
IFNαβ/γR-/-, STAT1-/-, CBA, HHD 등)
|
- 작은 규모
및 저비용으로 대규모 실험 가능
- 초기 백신
및 항바이러스제 스크리닝에 유용한 모델
|
- 일반적인
면역능력이 있는 마우스는 LASV 내성 보유 → 유전적 변형 필요 및 고려
- 제한된 시약
투여량
|
Guinea Pig Models
(Strain
13-inbred, Hartley-outbred 등)
|
- 작은 규모
및 저비용으로 대규모 실험 가능
- 초기 백신
및 항바이러스제 스크리닝에 유용한 모델
|
- 근친교배
기니피그 및 약간의 유전적으로 변형된 기니피그 확보에 어려움
- 제한된 시약
투여량
|
Non-Human Primate Models
(Cynomolgus
macaques, Rhesus monkey, Marmoset, Squirrel
monkeys 등)
|
- 영장류로서,
인간의 생리 및 면역반응과 가장 유사한 동물모델
- 실제
라싸열과 가장 유사한 임상적 징후 관찰 가능
-
백신/항바이러스 평가 및 병인 연구에서 가장 유용한 모델
|
- 고비용 및
관리의 어려움
- 숙련된
연구원 및 보조 필요
- 대규모
실험의 어려움
|
- ※ 위 표에서 볼드체로 표시한 동물모델들은 본
보고서의 논문 분석에 따른 라싸 바이러스의 S~A급 논문에서 가장 많이 사용되고 있는 동물모델임
- ※ 출처 : Animal Models of
Lassa Fever, Pathogens, 2020.
- 위 동물모델들은 각각 장·단점이 분명하게 존재하나, 그중에서도
라싸 바이러스의 영장류 모델로 가장 대표적인 Cynomolgus macaques 원숭이를 활용한 비임상 실험은 그 실험적 가치가
매우 높음6)
- 그 이유는 영장류가 인간과 가장 유사한 생리·면역학적 특성을
보이기 때문임
- 6) Animal Models of Lassa
Fever, Pathogens, 2020.
해외
1
임상시험 진행 중인 개발주체
INOVIO Pharmaceuticals
- Inovio Pharmaceuticals는 DNA를 기반으로
암 및 전염병 치료를 위한 합성 DNA 제품을 개발하는 미국의 생명공학 회사임
- Inovio의 기술은 조작된 DNA를 세포에 삽입하여
mRNA로 전사되고, 단백질로 번역되어 DNA에 의해 암호화된 단백질이 회복을 돕는 T-세포와 항체의 생산을 자극함으로써 암과
바이러스의 항원에 대한 면역반응을 유도함
- Inovio에서 개발 중인 라싸 바이러스
백신‘INO-4500’은 LASV Josiah(IV형) 균주의 LASV GPC(glycoprotein precursor) 유전자를
암호화하는 DNA 백신임
- 또한, 해당 백신은 Inovio의 CELLECTRA 스마트
기기를 사용하여 근육 내 또는 피하 내의 세포에 직접 전달하는 방식으로 접종함
- Inovio는 DNA 기반 라싸 바이러스
백신(INO-4500) 개발을 위해 CEPI(Coalition for Epidemic Preparedness
Innovations)의 자금을 지원받아 2번의 임상시험을 진행함
- 그러나, 2022년 11월 해당 백신은 임상과정에서 어느 정도
면역반응을 나타내는 결과를 보였지만, 2회 투여 요법에 따른 면역반응의 정도가 추가적인 개발을 위한 CEPI의 선택 기준에 미치지
못하여 개발을 중단하게 됨
- INO-4500 백신은 현재 1단계 임상평가
완료(NCT04093076, NCT03805984)
- Title : Dose-ranging Study:
Safety, Tolerability and Immunogenicity of INO-4500 in Healthy
Volunteers in Ghana, Safety, Tolerability and Immunogenicity of
INO-4500 in Healthy Volunteers
- Collaborator : Coalition for
Epidemic Preparedness Innovations
Themis Bioscience
- Themis Bioscience는 암과 전염병에 대한 면역조절
요법을 개발하고 있는 오스트리아의 백신 개발 제약사임
- Themis는 인체 면역 시스템의 메커니즘에 대한 뛰어난
통찰력으로 백신의 발견, 개발 및 생산뿐만 아니라 면역 시스템의 활성화 기전과 관련된 정교하고 다양한 기술 플랫폼을 구축함
- 특히, 세계 최고의 유럽 백신 연구기관인 Institute
Pasteur의 과학자들이 개발한 벡터를 기반으로 Themis는 홍역 바이러스 벡터 플랫폼을 개발하였으며, 광범위한 백신 후보 및
면역조절 요법 파이프라인을 보유하고 있음. 2020년에 미국의 거대 제약사 Merck에 인수합병됨
- Themis Bioscience에서 개발한 라싸 바이러스
백신은 홍역 바이러스(measles virus) 벡터를 기반으로 한 재조합 약독화 바이러스 벡터‘MV-LASV’백신으로, 해당
백신은 LASV Josiah(IV형) 균주의 LASV GP 및 LASV NP를 발현하는 재조합 홍역 바이러스임
- Themis는 재조합 약독화 바이러스 벡터 MV-LASV
백신의 상용화 개발을 위해 CEPI(Coalition for Epidemic Preparedness Innovations)로부터
자금을 지원받아 2019년에 임상 1상 실험을 진행함
- MV-LASV 백신은 현재 1단계 임상평가
완료(NCT04055454)
- Title : A Trial to Evaluate
the Optimal Dose of MV-LASV (V182-001)
- Collaborator : Coalition for
Epidemic Preparedness Innovations, Harmony Clinical Research Assign
Data Management and Biostatistics GmbH
International AIDS Vaccine
Initiative(IAVI)
- IAVI(International AIDS Vaccine
Initiative)는 HIV 감염 및 에이즈 예방을 위한 백신 개발을 가속화하기 위해 노력하는 글로벌 비영리 과학 연구기관임
- IAVI는 정책 분석 및 백신 후보군을 연구 개발하며,
에이즈뿐만 아니라 결핵, 신종감염병 및 소외 질병에 대한 백신과 항체를 개발함
- 특히, IAVI는 학계, 산업계, 지역 사회, 정부 및 자금
제공자 간의 협력을 촉진하여 빈곤한 사람들에게 불균형적인 공중보건 문제 해결을 위한 방법을 물색하고 개선하려는 연구를 하고 있음
- IAVI가 연구개발하고 있는 라싸
바이러스‘rVSV∆G-LASV-GPC’백신은 지난 2018년 IAVI가 캐나다의 공중 보건국 PHAC(Public Health
Agency of Canada)로부터 비독점 라이선스 계약을 통해 확보한 기술임
- rVSV∆G-LASV-GPC 백신은 VSV(Vesicular
Stomatitis Virus) 바이러스를 기반으로 한 재조합 수포성 구내염 바이러스 벡터 백신으로, LASV
Josiah(IV형) 균주의 LASV GPC(glycoprotein precursor)를 발현하는 약독화 재조합 수포성 구내염
바이러스임
- IAVI는 재조합 약독화 바이러스
벡터‘rVSV∆G-LASV-GPC’백신의 상용화 개발을 위해 CEPI(Coalition for Epidemic
Preparedness Innovations)로부터 일부 자금 지원 및 협력을 통해 임상 1상 시험을 진행하고 있으며, 임상
2상도 진행 예정임
- 현재, 서아프리카에서 해당 백신 임상 2상 진행을 위해
지원자를 모집하고 있음
- rVSV∆G-LASV-GPC 백신은 현재 1단계 임상평가 진행
중(NCT04794218) 및 2단계 진행 예정(NCT05868733)
- Title : A Clinical Trial to
Evaluate the Safety and Immunogenicity of rVSV∆G-LASV-GPC Vaccine in
Adults in Good General Heath, A Lassa Fever Vaccine Trial in Adults
and Children Residing in West Africa
- Collaborator : George
Washington University, Brigham and Women's Hospital, Redemption
Hospital, East-West Medical Research Institute Coalition for
Epidemic Preparedness Innovations
2
주요 특허 개발주체
큐어백(Curevac AG)
- CureVac AG는 메신저 RNA를 기반으로 한 치료법을
개발하는 독일의 바이오 제약사이며, 주로 세 가지 치료 영역인 감염병 예방 백신, 암 면역 요법 및 분자 요법에 초점을 두고
mRNA 기반 파이프라인을 구축함
- CureVac의 파이프라인에는 mRNA 기반 전염병 예방
백신으로 Influenza, COVID-19, Rabies virus, Lassa, Yellow fever, Rotavirus,
Malaria, 기타(Nipah virus) 등 다양한 전염병 백신을 개발하고 있음
- 지난 2019년, CureVac은 CEPI(Coalition
for Epidemic Preparedness Innovations)와 여러 병원체에 대한 mRNA 기반 백신 분야 기술인 RNA
Printer™ 개발을 위해 최대 3,400만 달러 규모의 파트너십 계약을 체결함
- RNA Printer™은 단 몇 주 내에 몇 그램의 LNP로
구성된 mRNA(10만 개 이상의 용량 생산)를 생산할 수 있어, 해당 플랫폼을 활용하여 여러 병원체에 대한 mRNA 백신 후보를
생산할 수 있음
- 이러한 혁신적인 플랫폼으로 3년간의 파트너십 계약조건에 따라
알려진 병원체(Lassa Fever, Yellow Fever, and Rabies)를 표적으로 한 백신 개발을 진행함
- 라싸 바이러스 백신 특허 출원 현황에서 CureVac AG는
S급 1건(Lassa virus vaccine), A급 1건(NOVEL LASSA VIRUS RNA MOLECULES AND
COMPOSITIONS FOR VACCINATION) 등 총 2건의 특허를 출원하여 주요 출원인으로서 활발하게 연구를 진행하고
있음
Scripps Research Institute
- Scripps Research institute는 기초 생의학
연구를 중점으로 한 의학 연구소로 미국의 비영리 의료 연구시설이며, 큰 규모의 실험 시설과 1,100개 이상의 특허 및 10개
이상의 FDA 승인 치료제를 보유한 세계에서 가장 영향력 있는 연구기관임
- 스크립스 리서치 연구소의 과학자들은 전염병의 유전체학을
사용하여 Zika, Ebola, Lassa 및 SARS-CoV-2와 같은 가장 치명적인 병원균의 발병 역학과 바이러스의 진화를
조사하고 있음
- 전산 생물학, 실험 및 현장의 결과를 조합하여 연구자들은
병원체 및 기타 새로운 병원체에 대한 백신 및 치료제 개발 방식의 변화를 희망하고 있음
- 지난 2022년 스크립스 리서치 연구소의 Ward와 그의
동료들은 나노입자를 사용하여 라싸 바이러스의 당단백질이 삼량체로 결합하는 기전을 발견함. 또한, 4개의 다른 라싸 바이러스
계통에서 당단백질 삼량체를 분리하여 구조적 특성화와 나노기술의 사용으로 서로 다른 계통에서도 당단백질의 구조는 매우 유사함을
밝혀냄
- 현재, Ward 연구팀은 라싸 바이러스 당단백질에 대한 더
많은 항체를 찾아내고 단백질 구조를 추가로 분석하여 당단백질에서 약물 표적화에 이상적인 위치를 식별하기 위한 향후 실험을 진행할
예정임
- 라싸 바이러스 백신 특허 출원 현황에서 SCRIPPS
RESEARCH INSTITUTE는 A급 1건(Arenavirus vaccine), B급 2건(ARENAVIRUS
MONOCLONAL ANTIBODIES AND USES, METHODS AND COMPOSITIONS RELATED TO
VIRAL VACCINES WITH IMPROVED PROPERTIES) 등 총 3건의 특허를 출원하여 주요 출원인으로서 활발하게
연구를 진행하고 있음
The Academy of Military
Medical Sciences(中国人民解放军军事科学院军事医学研究院)
- Academy of Military Medical
Sciences는 중국 상하이 군사 의학 연구소로 지난, 2014년 에볼라 바이러스 및 코로나 바이러스 백신 개발에 참여함
- 라싸 바이러스 연구에도 큰 관심을 보이고 있으며, 라싸
바이러스 백신 특허 출원 현황에서 Academy of Military Medical Sciences는 S급
2건(Recombinant virus expressing empty capsid of lassa fever virus and
preparation method of recombinant virus, Recombinant virus strain for
expressing double-copy Lassa fever virus GP gene as well as construction
method and application of recombinant virus strain)의 특허를 출원하여 주요 출원인으로서
활발하게 연구를 진행하고 있음
- 주요 특허 개발 주체에는 위 세 개의 연구 주체 외에도 미국
최고의 연구 대학 중 하나인 UNIVERSITY OF ROCHESTER, 미생물, 감염병, 백신 등에 관한 기초 및 응용 연구를
하는 프랑스의 비영리 연구기관 INSTITUT PASTEUR 등이 있음
뎅기 바이러스
개요
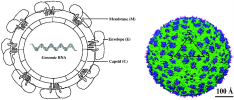
- 뎅기 바이러스(Dengue virus, DENV)는 Flaviviridae 과 Flavivirus 속에 속하는 외피 로
둘러싸인 양성 단일가닥 RNA 바이러스로, 바이러스에 감염된 매개성 모기에 물 려 인수공통 급성 열성 질환인 뎅기열을 일으키는
생물안전 3등급의 치명적인 병원 체 중 하나임
- 또한, 뎅기 바이러스는 대표적인 자연숙주로 이집트숲모기
Aedes aegypti 또는 흰줄 숲모기 Aedes albopictus가 있으며, 뎅기 바이러스에 감염된 매개모기에 물려 감염
이 전파됨
- 뎅기 바이러스에 의한 뎅기열은 무증상과 가벼운 두통 및 발열,
발진에서부터 염증 성 관절통, 뎅기출혈열, 뎅기쇼크증후군(혈장유출, 체액저류, 호흡곤란, 심한출혈, 장 기부전 등)과 같은 심각한
증상까지 다양하게 나타나며, 합병증으로 인해 사망에 이 를 수 있음
- 뎅기 바이러스는 18세기와 19세기에 열대지방 전역에 분포를
이루었지만, 20세기와 21세기 세계화로 인해 더 빠르게 확산되면서 다양한 혈청형의 바이러스가 유입되고 대부분의 세계 열대지역의
풍토병이 되었으며 계속해서 확산되고 있음
- 현재 뎅기열에 효과적인 치료제는 존재하지 않으며, 승인된
백신으로 사노피 파스 퇴르(Sanofi Pasteur)가 개발한 생약독화 황열병 Dengvaxia® 백신이 있으나, 주로 이전에
뎅기열 감염이 있었던 개인에게만 권장되며, 부작용이 커 여전히 큰 주의가 필요한 치명적인 바이러스 중 하나임
뎅기열(Dengue
Fever)과 뎅기 바이러스(Dengue virus)
| 정의 |
뎅기
바이러스(Dengue virus) 감염에 의한 급성 열성 질환1)2)
|
| 질병분류 |
제3급
감염병(질병코드: A90.0, A91.0) |
| 병원체 |
플라비바이러스과(Flaviviridae)
플라비바이러스속(Flavivirus)
뎅기 바이러스(Dengue virus)
(양성 단일가닥 RNA 바이러스)
|
|
| 주요 백신항원
|
structural
proteins(Premembrane(prM), Envelope(E)) |
| 병원소 |
숲모기류 (흰줄
숲모기 Aedes
albopictus or 이집트 숲모기 Aedes
aegypti), 사람 |
| 감염경로 |
숲모기 ↔ 사람
|
뎅기 바이러스에 감염된 매개모기에 물려 감염 전파
뎅기 바이러스에 감염되어 발열이 지속되는 사람을 흡혈 시 매개체(모기)에게 바이러스
전파 가능
|
| 사람 ↔ 사람
|
수혈, 성접촉,
태반, 모유 등 |
| 국내발생 |
2000년에
법정감염병으로 지정되었으며, 자체 국내발생 사례는 없음. |
| 국외발생 |
최초보고 |
뎅기 바이러스의
정확한 발생시기는 알기 어렵지만, 중국 진나라 시대(265~420년)에 발간된 책이
있을 정도로 오래 전부터 존재 |
| 발생동향 |
전 세계 100여개
이상의 국가에서 발생, 풍토지역은 주로 열대와 아열대지방에 걸쳐 적도를 기준으로 남북
위도 35°까지 매우 광 범위함, 뎅기열을 전파시키는 모기가 주로 고인 물에서 번식하기
때문에 우기에 환자가 급증함 |
| 위험지역 |
| 해외유입 |
해외유입으로 인한
국내 신고현황 : 2013-2019년 평균 227명, 2020년 43명, 2021년
3명, 2022년 104명 |
| 잠복기 |
5-7일 |
| 임상 증상 |
-
뎅기열은 질병의 경과가 다양하고 감염자 중 약 75% 정도가 무증상,
증상이 발생 하는 경우 대부분 비특이적 증상 혹은 급성 열성 증상이
나타남
-
일반적으로 뎅기열의 임상경과는 발열기, 급성기, 회복기로 진행
-
발열기(Febrile phase) : 일반적으로 2-7일 정도
지속됨
- 두통, 근육통, 발진, 관절통, 백혈구/혈소판 감소, 간기능수치 증가
등 다양한 질환 발생
-
급성기(Critical phase/Plasma leak phase) :
해열 이후부터 1~2일(4일) 지속
- 대부분의 환자는 이 시기에 회복
- 심각한 혈장 유출이 있는 환자는 혈관투과성 증가로 인해 중증 뎅기열로
발전 가능
-
회복기(Recovery or Convalescent phase)
- 환자는 적혈구 용적률이 안정화되고 이뇨 현상도 좋아지며 호전
- 회복기 단계에서의 발진은 피부가 벗겨지거나 가려움증을 유발
-
전체 뎅기열 환자 중 약 5% 정도는 중증 뎅기 감염증을 보임
- 뎅기출혈열, 뎅기쇼크증후군으로 불림
- 성인보다 소아에서 주로 발생하며, 주요 증상으로 복통, 지속적인
구토, 빠른 호흡, 혈장유출, 체액저류, 심한 출혈, 장기부전 등의
합병증으로 사망에 이르기도 함
- 이전에 감염된 환자가 다른 혈청형에 재감염되면 중증 뎅기열로 진행되기
쉬움
|
| 치명률 |
조기에 치료 시
1%, 치료시기가 늦을 경우 약 20% |
| 진단 |
검체(혈액, 체액
등)에서 특이 유전자 검출(Real-time RT-PCR) |
| 치료 |
전 세계적으로
특화된 치료제 없어 증상에 따른 대증치료가 최선 |
| 예방 |
- 전
세계적으로 상용화된 FDA 승인 백신 Dengvaxia®이 존재하나
이전에 뎅기열 감염이 있었던 개인에게만 권장되며, 부작용이 큼
-
유행지역 여행 시 모기에 물리지 않는 것이 가장 중요함(모기 기피제, 긴
옷 등)
|
출처
: 뎅기열 질병 개요, 질병관리청, 2022., [제3급] 뎅기열, 부산광역시 감염병관리지원단, 2023, 재구성.
- 1) 뎅기열 질병 개요, 질병관리청, 2022.
- 2) [제3급] 뎅기열, 부산광역시
감염병관리지원단, 2023.
국내외 연구개발 동향
1
뎅기 바이러스 감염증의 치료제 및 백신 개발 동향
뎅기 바이러스 감염증의 백신 후보군
- 현재 뎅기열의 유일한 FDA 승인 백신은 사노피
파스퇴르(Sanofi Pasteur)가 개발 한 생약독화 황열병 기반 Dengvaxia® 백신이 있으며, 이어 임상 3상 시험이
진 행 중인 Takeda 제약의 생약독화 TAK-003 백신과 NIAID(국립 알레르기 및 전염 병 연구소, Butantan
Institute)의 생약독화 TV003/TV005 백신 등이 있음3)
- 이외에도, TDENV-LAV, V181, rDEN1, 2,
3, 4Δ30, TDENV-PIV, V180, DENV NS1, cED III, pNS1-tPA, TVDV, CAdVax-Den,
Baculovirus-expressed NS1, MV-DEN, DSV4, VEE-VRP 백신 등의 임상시험 및 전임상 연구가 진행
중임
- 3) Dengue overview: An updated
systemic review, J Infect Public Health, 2023.
뎅기 바이러스 감염증의 치료제 후보군
- 현재, 뎅기 바이러스의 승인된 치료제는 존재하지 않으며,
개발되고 있는 대표적 인 치료제에는 뎅기열 혈장누출 억제제로서 Ketotifen, Montelukast 및 항바이러 스제로서
활용되는 EYU688, AT-752, Ivermectin, JNJ-64281802, Atibuclimab(IC14),
Chloroquine, Celgosivir, Melatonin 등이 임상 1/2상 이상에 주로 분포되어 있음4)
- 이어서 Modipafant, Dengushield, AV-1,
Zanamivir, Balapiravir, Dexamethasone, Lovastatin, Single donor platelet
transfusion, Recombinant human IL-11, Prednisolone, Carbazochrome sodium
sulfonate 등이 연구되고 있음5)
- 4) Inhibitory Potential of
Chromene Derivatives on Structural and Non-Structural Proteins of
Dengue Virus, Viruses, 2022.
- 5) Dengue: A Minireview,
Viruses, 2020.
2
뎅기 바이러스 감염증의 동물모델
뎅기 바이러스 동물모델의 종류
- 뎅기 바이러스의 백신 및 치료제 개발을 위해 비임상 실험에서
활용되는 대표적 인 동물모델에는 마우스, 원숭이(영장류), 돼지, 나무두더지가 있음6)
- 최근 뎅기열 감염 모델로 적합한 동물모델이 개발되고 있으며,
이러한 동물모델 중에서는 일부 유전적 변형을 통해 뎅기열의 임상적 징후와 유사한 양상을 띠게 유도한 경우가 상당수 있음
-
뎅기 바이러스 동물모델
| 뎅기 바이러스 동물모델
|
장점 |
단점 |
Murine Models
(C57BL/6
and BALB/c mice, AG129 mice, Humanized
mice)
|
- 작은 규모
및 저비용으로 대규모 실험이 가능
- 방대한
문헌, 도구 및 시약의 가 용성이 큼
- 형질전환
동물을 이용한 실험 용이
- 뎅기열로
인한 높은 바이러스혈 증, 혈소판감소증 재현 가능
|
- 진화적 거리
- 일부 종에서
명백한 임상적 증상 부족
- 시약 투여량
및 분석 시간제한
- 제한된 면역
반응
|
| NHP (Rhesus
macaques, Cynomolgus macaques, Marmoset, Bonnet
macaque, Chimpanzee) Models |
- 영장류로서,
인간의 생리 및 면 역반응과 가장 유사하고 진화적 으로 근접한 모델
- 감염 과정과
바이러스혈증, 증식 및 확산, 바이러스 지속성 등 실 제 뎅기열과 가장 유사한
임상적 징후 관찰 가능
|
- 대형동물로서
고비용 및 관리 어 려움
- 숙련된
연구원 및 보조 필요
- 윤리적 제약
문제
- 일부 종에서
명백한 임상적 증상 부족
|
Swine Models
(Yucatan
miniature pig)
|
-
바이러스혈증, 피부 발진 등 뎅 기열 임상적 증상 관찰 가능
- 비교적
저비용
- 면역학적
시약의 가용성
- 일부 종에서
인간과 유사한 생리 적/면역학적 반응 관찰 가능
|
|
| Tree shrew
Models |
- 체온 상승,
혈소판 감소증 등 뎅 기열 임상적 증상 관찰 가능
- 설치류보다
영장류와 유전적 유 사성이 더 높고 뎅기열 관련 항 바이러스제 및 백신 평가에
적합 함
|
- 매우 낮은
바이러스혈증
- 명백한
임상적 징후 부족
|
- ※ 각 동물모델에서 다른 종별로 특징을 나타낸
구체적인 자료는 출처 논문 자료를 참고 바람.
- ※ 출처 : Mammalian animal
models for dengue virus infection: a recent overview, Arch
Virol, 2022. 재구성.
- 위 동물모델들은 각각 장·단점이 분명하게 존재하나, 그중에서도
뎅기 바이러스 의 영장류 모델로 가장 대표적인 Cynomolgus macaques, Rhesus macaques 원숭 이를 활용한
비임상 실험은 그 실험적 가치가 매우 높음
- 그 이유는 영장류가 인간과 가장 유사한 생리·면역학적 특성을
보이기 때문임
- 6) Mammalian animal models for
dengue virus infection: a recent overview, Arch Virol, 2022.
해외
NIAID(National Institute of
Allergy and Infectious Diseases)
- 미국의 NIAID(국립 알레르기·전염병 연구소)는 미국
보건복지부(HHS; Health & Human Services)의 산하기관 중 하나인 미국 국립보건원(NIH;
National Institute of Health)을 구성하는 27개의 기관 및 센터 중 하나임 • NIAID의 주요 목표는
전염성, 면역성 및 알레르기성 질환에 대한 해석과 백신 및 치료제 개발이며, 이를 위한 기초 및 응용 연구를 수행하고 있음
- NIAID에서 개발한 TV003/TV005 뎅기 바이러스
백신은 약 30여 개의 뉴클레오티 드가 결실된 4가지 뎅기 바이러스 백본을 제공하는 키메라 생약독화 백신으로, 해당 백신은
live virus 그 자체가 항원으로 작용하여 숙주에게 면역원성을 부여 함
- NIAID는 TV003/TV005 백신을 브라질의 비영리
면역생물학제제 생산업체인 부탄 탄 연구소(Butantan Institute)에 라이선스하였으며, 현재 부탄탄 연구소에서 키메 라
생약독화 TV003/TV005 백신의 상용화를 위한 임상 3상 시험을 비롯하여, 다 양한 임상시험 연구를 진행하고 있음
- 앞서 언급한 미국 보건복지부(HHS)의 경우 임상 현황에서는
직접적인 Sponsor로 나타나지 않고 하위기관인 NIAID의 이름으로 다수의 임상시험이 확인되었으며, 특허분야에서는 이와 관련된
뎅기 바이러스 혈청형 1, 2, 3 및 4에 대한 키메라 뉴클레오티드 결실(Δ30)로 인한 약독화 백신 관련 특허를 출원하여 주요
출원인 으로서 활발하게 연구를 진행하고 있음
- TV003/TV005 백신은 현재 다수의 1, 2, 3단계
임상평가 진행 및 완료(대표 임상 시험, NCT02406729 등)
- Title : Phase III Trial to
Evaluate Efficacy and Safety of a Tetravalent Dengue Vaccine
- Sponsor and Collaborator :
Butantan Institu
Takeda Pharmaceutical &
Co.
- Takeda Pharmaceutical Company(다케다
제약)은 일본 최대의 제약기업으로 매출 액 기준 세계 9위의 대규모 제약기업임
- 다케다 제약은 주로 항암제, 위장관질환, 중추신경계와 관련된
치료제 분야와 글 로벌 백신 사업으로 뎅기열, 코로나19, 유행성 독감, 지카 바이러스 등 세계에서 가장 해결하기 어려운 전염병을
위해 혁신적인 연구를 진행하고 있음
- 다케다 제약에서 개발 중인 TAK-003 백신은 4가지 뎅기
바이러스 모두의 백본을 제공하는 혈청형 2에 기반을 둔 생약독화 백신으로, 해당 백신은 live virus 그 자 체가 항원으로
작용하여 숙주에게 면역원성을 부여함
- 현재, 다케다 제약의 TAK-003 백신은 미국 생물학적 제제
허가 신청(BLA)를 자 발적으로 철회하고 관련하여 미국 식품의약국(FDA)와 추가 논의 중에 있음
- 지난 2019년 최초로 FDA 승인을 받은 뎅기열 백신인
Dengvaxia® 이후 2번째로 FDA 승인에 가장 가까운 백신이며, 이미 여러 뎅기열 풍토병 국가와 비풍토병 국가에서 승인됨
- 다케다 제약의 TAK-003 백신은 지금도 많은 임상시험
연구를 진행하고 있음
- TAK-003 백신은 현재 다수의 1, 2, 3단계 임상평가
진행 및 완료(대표 임상시험, NCT02747927 등)
- Title : Efficacy, Safety and
Immunogenicity of Takeda's Tetravalent Dengue Vaccine (TDV) in
Healthy Children
- Collaborator : No information
provided
US. Army Medical Research
& Development command(USAMRDC)
- 미국의 USAMRDC(미 육군 의료 연구개발 사령부)는 군
전염병, 전투 사상자 치 료, 군 작전 의학, 화학 생물학적 방어, 임상 및 재활의학 등 5가지 분야의 연구 를 진행하고 있음
- 또한, USAMRDC는 의학 및 연구개발의 프로그램 중 하나인
MIDRP(Military Infectious Diseases Research Program, 군사 전염병 연구 프로그램)을
진행하고 있음
- MIDRP는 전투원의 준비 태세와 성과를 극대화하면서 전체
병력에 대한 전염병 위협을 예방 및 예측하고 치료하는 국방부 요구 사항 중심의 의료 솔루션을 계 획, 조정 및 감독하는 것이 주요
목적임
- MIDRP는 전염병 위협이 군의 운영 및 준비 상태에 미치는
부정적인 영향을 제거 하기 위해 치료제 및 백신의 개발을 지원하고 있으며, 주목하고 있는 전염병으로 세균성 설사병, 상처 감염성
질병, 뎅기열, HIV, 한타바이러스, 신종 전염병 등이 있음
- 현재, USAMRDC가 지원하고 있는 혹은 개발하고 있는
생약독화 TDEN F17/F19 백신으로, 해당 백신은 live virus 그 자체가 항원으로 작용하여 숙주에게 면역원 성을
부여함
- USAMRDC는 생약독화 TDEN F17/F19 백신의
상용화를 위한 다양한 임상시험 연 구를 진행하고 있음
- TDEN F17/F19 백신은 현재 다수의 1, 2상 임상평가
진행 및 완료(대표 임상시험, NCT00370682 등)
- Title : A Phase II Trial of a
Live Attenuated Virus Tetravalent Dengue Vaccine in Healthy Adults
in Thailand
- Collaborator : GlaxoSmithKline
Sanofi(Sanofi pasteur)
- Sanofi는 프랑스의 다국적 제약회사로 인간의 삶의 질
개선을 위한 치료 솔루션 을 연구, 개발 및 제공하는 세계 선두의 글로벌 제약 기업임
- 사노피는 암, 희귀질환, 다발성 경화증 치료용 의약품에서부터
다양한 박테리아 및 바이러스 질병을 예방하기 위한 백신 등 다양한 포트폴리오를 보유하고 있음
- 사노피에서 주로 백신 개발에 전념하는 백신 글로벌 사업부
Sanofi pasteur(사노 피 파스퇴르)는 백신에만 전념하는 세계 최대 기업이며, 인플루엔자, 수막염, 뎅 기열, 여행 및
풍토병을 포함한 어린이, 청소년 및 성인을 위한 다양한 고품질의 백신 포트폴리오를 보유하고 있음
- 사노피 파스퇴르에서 개발한 뎅기 바이러스 Dengvaxia
®(CYD-TDV) 백신은 황열 병 바이러스의 백신 균주(YFV-17D)를 기반으로 한 4가지 뎅기 바이러스 혈청형 의 키메라
생약독화 백신으로, 해당 백신은 live virus 그 자체가 항원으로 작용하 여 숙주에게 면역원성을 부여함
- Dengvaxia ®(CYD-TDV) 백신은 제한적이지만
최초로 뎅기열에 대한 FDA 승인 백신이며, 제한적 FDA 승인 이전에 이미 2015년 멕시코에서 전 세계 최초 뎅기 열 예방
백신으로 승인을 받음
- 이듬해 2016년에는 필리핀, 인도네시아, 브라질,
엘살바도르, 코스타리카, 파라과 이, 과테말라, 페루, 태국, 싱가포르 등 총 11개국에서 상용화됨
- 그러나 2017년 말 백신 접종 후 소아 환자가 집단으로
사망하는 사례가 계속해서 발생하여 예방접종을 중단하고 수사까지 진행됨
- 현재, 사노피는 황열병 백신 균주를 기반으로 한 키메라
생약독화 백신 (CYD-TDV)과 다양한 종류의 백신(일본뇌염, 황열병, 인간유두종 바이러스 백신 등) 과의 병용 요법에 대한
임상시험을 진행하고 있으며, 추가적인 백신 관련 특 허를 출원하여 주요 출원인으로서 활발하게 연구를 진행하고 있음
Merck & Co.
- 미국과 캐나다 이외의 지역에서는 MSD로 알려진 선도적인
글로벌 바이오제약사 인 Merck는 100년이 넘게 세계에서 가장 어려운 질병에 대한 의약품과 백신을 개발해오고 있음
- Merck의 주요 초점 분야에는 종양학, 백신,
전염병(HIV, Ebola, Dengue 등), 코로 나19, 심장 대사 장애, 현재와 미래에 가장 큰 변화를 만들 수 있는
과학적 발견 및 개발 등이 있으며, 전 세계 수백만 명의 사람들에게 도움이 될 수 있는 의약 품과 백신을 제공하기 위한 과학적
혁신에 집중함
- 지난 2019년 Merck는 브라질 상파울루 소재의 비영리
면역생물학 제품 생산업체 인 Institute Butantan과 모기 매개 감염성 질병인 뎅기 바이러스를 예방하기 위한 백신개발에
협력 계약을 체결함
- 두 회사의 합작으로 연구개발하고 있는 뎅기 바이러스 예방 백신
TetraVax-DV(V180)은 보조제(ISCOMATRIX or Alhydrogel)가 첨가된 재조합 (DEN-80E) 4가
서브유닛 백신으로, 해당 백신의 4가지 혈청형에 대한 잘려진 형 태의 외피 단백질(DEN-80E)이 항원으로 작용하여 숙주에게
면역원성을 부여함
- 현재 TetraVax-DV(V180)은 2개의 임상 1상
시험을 완료하였으며, 해당 백신과 관 련된 특허를 출원하여 주요 출원인으로서 활발하게 연구를 진행하고 있음
한타 바이러스
개요
- 한타바이러스(Hantavirus)는 Hantaviridae 과
Orthohantavirus 속에 속하는 외피로 둘러싸인 음성 단일 가닥 RNA(3개 분절) 바이러스로,
한탄(Hantaan), 서울(Seoul), 도브라마(Dobrava), 푸말라(Puumala) 바이러스 등이 대표적 예에 해당함
- 한타바이러스는 감염된 매개성 설치류에게 물려 전파되거나
설치류의 배설물, 소변 등의 공기 중 에어로졸이 호흡기나 상처 난 피부에 침투하여 전파될 수 있음
- 한타바이러스는 인수공통 급성 발열성 질환인 신증후군출혈열 및
한타바이러스 폐 증후군을 유발하는 생물안전 3등급의 치명적인 병원체 중 하나임. 또한, 한타바이러스의 대표적인 자연 숙주로
국내에서는 등줄쥐(Apo-demus agarius), 집쥐(Rattus norvegicus)가 있으며, 해외 각국에서는 다양한
종류의 설치류가 감염을 전파함
- 한타바이러스에 의한 임상적 증상은 38℃ 이상의 고열과
오한에서부터 혈소판 감소, 저혈압, 신부전, 혈변, 폐부종, 탈수 등과 같은 심각한 증상에 이르기까지 다양하게 나타나며,
합병증으로 인해 사망에 이를 수 있음
- 우리나라에서 한타바이러스는 1950년 한국전쟁 당시 처음으로
발생하였으며, 이후 1976년 우리나라의 이호왕에 의해 동두천 한탄강 유역에서 병의 병원체를 발견하여 한탄바이러스로 명명함.
한타바이러스는 한탄바이러스 이외에도 서울바이러스 등 40여 종 이상 존재함
- 전 세계 등지에서 연간 약 20만 명 이상의 환자가 발생하고
있으며, 국내에도 2000년 이후 매년 약 300~500명의 환자가 발생하고 있음
- 현재 한타바이러스에 전 세계적으로 특화된 치료제 및 백신이
존재하지 않아, 유행 지역의 산이나 풀밭에 가는 것을 피하고 설치류와의 접촉을 최소화하는 것이 예방책이며, 증상에 따른 대증적
치료 (수분 및 혈압 조절, 투석 등)가 최선임
신증후군출혈열(hemorrhagic
fever with renal syndrome; HFRS)과 한타바이러스(Hantavirus; Hantaan)
virus/Seoul virus
| 정의 |
신증후군출혈열은
한타바이러스(Hantavirus; Hantaan virus/Seoul virus)
감염에 의한 급성 발열성 질환 |
| 질병분류 |
제3급
감염병(질병코드: A98.5) |
| 병원체 |
한타바이러스과(Hantaviridae)
한타바이러스속(Orthohantavirus)
한타바이러스(Hantavirus)
(음성 단일 가닥 RNA 바이러스)
|

|
| 주요 백신항원
|
Glycoproteins(Gc, Gn), Nucleocapsid protein
(NP),
RNA dependent RNA polymerase (RdRp) |
| 병원소 |
등줄쥐(Apo-demus
agarius), 집쥐(Rattus
norvegicus) |
| 감염경로 |
설치류 → 사람
|
바이러스에 감염된 설치류의 배설물, 오줌, 타액 등을 통해 바이러스를 체외로 분비하며,
먼지와 함께 공중에 떠다니다가 상처가 난 피부 또는 눈, 코, 입 등을 통해 사람에게
전파
|
| 사람 간 전파
|
사람 간 전파
사례는 극히 드묾 |
| 국내발생 |
제3급
법정감염병으로 지정된 해에 176명이 신고되었고, 2000년 이후에는 매년 약
400~500명 내외로
증감을 반복하고 있음.
2021년에는 전년 대비 14.8% 증가함 |
| 국외발생 |
최초보고 |
1951~1953년
한국전쟁 중 UN군에서 3,200명 이상의 신증후군출혈열 환자가 발생하고 수백 명이
사망함 |
| 발생동향 |
한국, 중국,
러시아, 유럽, 미국 등 세계적으로 광범위하게 분포하고 있으며, 매년
전 세계적으로 15만 명 이상의 환자가 발생함. 지역마다 특정 한타바이러스 종이
분포하고 해당 종의 매개체 분포와 대체로 일치함 |
| 위험지역 |
| 해외유입 |
| 잠복기 |
1~2주(최대
8주) |
| 임상 증상 |
-
신증후군출혈열은 무증상에서 사망에 이르기까지 다양한 임상적 양상을
보이며, 3대 주요 증상으로 발열, 출혈, 신부전이 있고 아래와 같이
5단계로 나뉨
-
발열기(3~5일) : 발열 및 전신 증상 등
-
저혈압기(1~3일) : 해열 후 24~48시간, 저혈압, 혈소판 감소,
쇼크 출혈성 경향
-
핍뇨기(3~5일) : 무뇨, 신부전, 혈뇨, 고혈압, 뇌부종, 폐부종
-
이뇨기(7-14일) : 신장 기능 회복, 많은 양의 소변 배출, 심한
탈수, 쇼크로 사망할 수 있음
-
회복기(3~6주) : 전신 쇠약감이나 근력 감소 등을 호소하나 서서히
회복됨
|
| 치명률 |
바이러스의 종류에
따라 1% 미만에서 최대 15%로 다양하나, 치명률은 보통 5-15% |
| 진단 |
검체(혈액, 체액
등)에서 특이 유전자 검출(Real-time RT-PCR) 및 항원 검출 검사 |
| 치료 |
전 세계적으로
특화된 치료제 및 백신이 없어 증상에 따른 대증치료가 최선 |
| 예방 |
군인, 농부, 실험실 요원 등 한탄바이러스로 오염된 환경에 자주 노출되는 사람에게 일부
불활성화
백신인 Hantavax®(일부 국가 승인) 접종 권장, 유행 지역의 산이나 풀밭에 가는
것을 피하고 설치류와의 접촉을 최소화
|
출처 : 서울특별시 감염병 주간 소식, 서울특별시 시민건강국 감염병연구센터, 2023.
[제3급] 신증후군출혈열, 부산대학교병원 부산광역시 감염병관리지원단, 2023.
진드기・설치류 매개 감염병 개요, 질병관리청, 2022
국내외 연구개발 동향
1
한타바이러스의 백신 및 치료제 개발 동향
한타바이러스 감염증의 백신 연구개발
- 현재 한타바이러스의 FDA 승인 백신은 없으나, 국내 및
중국에서는 한탄바이러스와 서울바이러스의
감염 예방을 위해 승인된 한탄바이러스 불활성화 백신인 ‘Hantavax®’가 있음
- 최근 몇 년간 ‘Hantavax®’의 접종으로 한타바이러스의
감염 발생률이 다소 감소함.
또한, 중국에서는 한타바이러스의 예방 백신으로 시판되고 있는 한탄바이러스 및 서울바이러스 불활성화 백신‘Hanpuwei®’가 있음
- 이처럼 일부 국가에서만 승인되어 시판되고 있는
‘Hatavax®’와 ‘Hanpuwei®’는 한타바이러스 감염에 대한 최적화된 면역반응을 유도하기에는
어려움이 있으며, 크고 작은 안전성 문제가 존재함
- 이에 최적화된 한타바이러스 백신의 개발은 여전히 중요하며,
현재 사람을 대상으로 임상시험을
진행 중인 백신에는 한타바이러스의 M 세그먼트를 활용한 DNA 백신이 유일함1)2)
- 비임상시험에서 활발히 개발 중인 주요 백신에는 단백질 서브유닛
백신이 다수 개발되고 있음
- 한타바이러스의 백신으로 연구개발 중인 백신의 주요 항원으로는
대부분이 M 세그먼트 즉,
Gn/Gc 당단백질을 항원으로 한 백신이 다수 개발되고 있음
- 1) Vaccines and Therapeutics
Against Hantaviruses, Front Microbiol, 2020.
- 2) Progress on the Prevention
and Treatment of Hantavirus Disease, viruses, 2019
한타바이러스 감염증의 치료제 연구개발
- 현재 한타바이러스의 승인된 치료제는 존재하지 않으며,
비임상시험에서 연구되고 있는 치료제로는
광범위한 바이러스의 증식을 억제하여 항바이러스제(리바비린)로 사용되는 저분자 화합물 또는
항체가 있으며, 주로 한타바이러스의 진입을 차단하거나 바이러스의 복제를 억제하는 작용을 통해
치료제로써 연구되고 있음
- 이외에도 숙주를 표적으로 한 지지요법 치료제로 혈관 기능을
개선하거나 면역 항상성을 회복하도록 설계된 치료제가 연구되고 있음
2
한타바이러스 감염증의 동물모델
한타바이러스 동물모델의 종류
- 현재 한타바이러스 감염에 대한 동물모델, 특히
신증후군출혈열(HFRS; Hemorrhagic Fever
with Renal Syndrome) 관련 동물모델은 상대적으로 제한적이며, 적합한 동물모델을 개발하기 위해 활발히 연구개발을
진행하고 있음3)
- 아래의 표는 한타바이러스의 발병기전 평가를 위해 개발되고 있는
동물모델4)을 나타낸 것임
-
한타바이러스의 동물모델
개발 현황
|
Animal model |
Salient
features |
OW
(Old World)
|
HTNV
|
ICR suckling mice
|
Only in mice infected within 72 hrs of birth,
decreasing thereafte
|
|
HTNV
|
ICR suckling mice
|
Mice infected 2 to 4 days after birth
|
|
HTNV
|
BALB/c suckling mice
|
Mice infected within 24 hrs of birth
|
|
HTNV
|
Striped field mice
|
Antigen, not infectious virus, and
persists in lung for 1 yr
|
|
HTNV
|
6–10-week-old Syrian hamsters
|
Asymptomatic infection
|
|
PUUV
|
6–10-week-old Syrian hamsters
|
Asymptomatic infection
|
|
PUUV
|
Suckling and weanling bank voles
|
Asymptomatic, persistent infection NHP exhibit
lethargy,
|
|
PUUV
|
Cynomolgus macaques
|
proteinuria, and microhematuria, with
histopathological changes in the kidney
|
|
DOBV
|
1–5-day-old NMRI suckling mice
|
Viremia, neutralizing antibodies, and elevated
levels of NO detected
|
|
DOBV
|
6–8-week-old Syrian hamsters
|
Asymptomatic infection
|
|
SEOV
|
6-day-old Lewis rats
|
Asymptomatic, persistent infection
|
|
SEOV
|
Syrian hamsters (no age specified)
|
Asymptomatic infection
|
|
SEOV
|
70–80-day-old Norway rats
|
Asymptomatic, persistent infection
|
|
SEOV
|
Syrian hamsters (no age specified)
|
Asymptomatic infection
|
NW
(New World)
|
ANDV
|
6–8-week-old Syrian hamsters
|
Recapitulates human disease in incubation time,
rapid-progressing respiratory distress, and
pathologic findings in the lung
|
|
SNV
|
6–8-week-old Syrian hamsters
|
Asymptomatic infection, no viremia, and little
dissemination Hamster-adapted SNV increases
dissemination
|
|
SNV
|
6–8-week-old Syrian hamsters
|
Hamsters immunosuppressed with
dexamethasone and cyclophosphamide
|
|
SNV
|
Rhesus macaques
|
Using only deer mouse-passaged SNV
|
|
SNV
|
4–6-week-old deer mice
|
Asymptomatic, persistent infection
|
|
MAP
|
4-week-old Syrian hamsters
|
Recapitulates human disease in incubation time,
rapid-progressing respiratory distress, and
pathologic findings in the lung
|
|
PHV
|
Cynomolgus macaques/Chimpanzee
|
Mild, transient proteinuria
|
- ※ 출처 : Animal Models for
the Study of Rodent-Borne Hemorrhagic Fever Viruses:
Arenaviruses and
Hantaviruses, Biomed Res Int, 2015. 재구성
- 3) Pathogen Dose in Animal
Models of Hemorrhagic Fever Virus Infections and the Potential
Impact on Studies of the Immune Response, Pathogens, 2021.
- 4) Animal Models for the Study
of Rodent-Borne Hemorrhagic Fever Viruses: Arenaviruses and
Hantaviruses, Biomed Res Int, 2015.
해외
1
임상시험 진행 및 특허 개발주체
NIAID(National Institute of
Allergy and Infectious Diseases)
- 미국의 NIAID(국립 알레르기・전염병 연구소)는 미국
보건복지부(HHS; Health & Human Services)의
산하기관 중 하나인 미국 국립보건원(NIH; National Institute of Health)을 구성하는 27개의 기관 및
센터 중 하나임
- NIAID의 주요 목표는 전염성, 면역성 및 알레르기 질환에
대한 해석과 백신 및 치료제 개발이며, 이를
위한 기초 및 응용 연구를 수행하고 있음
- NIAID에서 개발하고 있는 백신은 pWRG7077
플라스미드에 안데스 바이러스의 M 유전자 서열을 삽입
하고 추가적인 유전자 조작 과정을 거쳐 백신의 면역원성을 강화한 한타바이러스‘pWRG/AND-M(opt2)’ANDV
DNA 백신으로 백신 접종 시 안데스 바이러스의 Gn/Gc 당단백질을 발현하여 숙주에게 항원으로 작용하고
면역원성을 부여함
- NIAID는 한타바이러스 ANDV DNA 백신의 개발을 위해
관련 임상시험을 진행함
- NIAID의 ANDV DNA 백신은 현재 1단계 임상 평가
완료(대표 임상시험, NCT03682107)
- Title : Andes Virus DNA
Vaccine for the Prevention of Hantavirus Pulmonary Syndrome
Using the PharmaJet Stratis(R) Needle-Free Injection Delivery Device
- Sponsor and Collaborator:
National Institute of Allergy and Infectious Diseases(NIAID)/No
information provided
US. Army Medical Research &
Development command(USAMRDC)
- 미국의 USAMRDC(미 육군 의료 연구개발 사령부)는 군
전염병, 전투 사상자 치료, 군 작전 의학, 화학
생물학적 방어, 임상 및 재활의학 등 5가지 분야의 연구를 진행하고 있음
- 또한, USAMRDC는 의학 및 연구개발의 프로그램 중 하나인
MIDRP(Military Infectious Diseases
Research Program, 군사 전염병 연구 프로그램)을 진행하고 있음
- MIDRP는 전투원의 준비 태세와 성과를 극대화하면서 전체
병력에 대한 전염병 위협을 예방 및 예측하고
치료하는 국방부 요구 사항 중심의 의료 솔루션을 계획, 조정 및 감독하는 것이 주요 목적임
- MIDRP는 전염병 위협이 군의 운영 및 준비 상태에 미치는
부정적인 영향을 제거하기 위해 치료제 및
백신의 개발을 지원하고 있으며, 주목하고 있는 전염병으로 세균성 설사병, 상처 감염성 질병, 뎅기열, HIV, 한타바이러스, 신종
전염병 등이 있음
- USAMRDC가 개발하고 있는 백신은 pWRG7077
플라스미드에 한탄바이러스 및 푸말라 바이러스의 M
유전자 서열을 삽입하고 추가적인 유전자 조작 과정을 거쳐 백신의 면역원성을 강화한 한타바이러스
‘pWRG/HTN-M(co), pWRG/PUU-M(s2)’HTNV/PUUV DNA 백신으로 개별 및 혼합물을 백신 접종 시
한탄 및 푸말라 바이러스의 Gn/Gc 당단백질을 발현하여 숙주에게 항원으로 작용하고 면역원성을 부여함
- USAMRDC는 한타바이러스 HTNV/PUUV DNA 백신의
개발을 위해 관련 임상 및 특허를 출원하여
주요 출원인으로서 활발하게 연구를 진행하고 있음
- USAMRDC의 HTNV/PUUV DNA 백신 관련 임상시험은
현재 다수의 임상 1, 2단계 평가 진행 및 완료
(대표 임상시험, NCT02116205 등)
- Title : Phase 2a
Immunogenicity Study of Hantaan/Puumala Virus DNA Vaccine for
Prevention of Hemorrhagic Fever
- Collaborator: U.S. Army
Medical Research and Development Command/No information
provided
Air Force Medical
University(中国人民解放军空军军医大学)
- 중국의 공군의과대학은 군사 관련 의학 및 심리 과학 연구를
주로 하고 있으며, 2017년 시진핑 주석의
군사 개혁 이후 공군 지휘하에 PLA(People's Liberation Army Air Force)에 편입된 중국의 의학 및
심리 과학 연구기관임
- 현재, 중국 공군의과대학에서 개발하고 있는 한타바이러스 백신은
단백질 서브유닛 백신의 일종으로 한탄
및 서울바이러스의 Gn/Gc 외피 당단백질을 발현하여 백신 접종 시 숙주에게 면역원성을 부여함
- 중국 공군의과대학은 한타바이러스의 단백질 서브유닛 백신의
상용화를 위해 관련 특허를 출원하여 주요
출원인으로서 활발하게 연구를 진행하고 있음
중증열성혈소판감소증후군 바이러스 (SFTSV)
개요
- 중증열성혈소판감소증후군 바이러스(Severe Fever Thrombocytopenia Syndrome; SFTS)는
Phenuiviridae 과
Bandavirus 속에 속하는 외피로 둘러싸인 음성 단일 가닥 RNA 분절 바이러스로, 바이러스에 감염된 매개성 진드기에게 물려 인수공통 중증 열성 바이러스성
질환인 중증열성혈소판감소증후군을 일으키는 생물안전 3등급의 치명적인 병원체 중 하나임
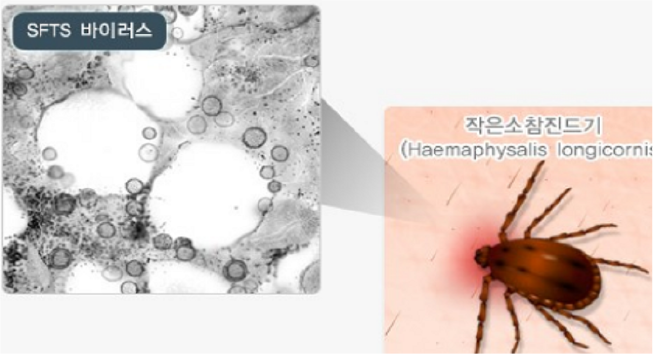
- 또한, 중증열성혈소판감소증후군 바이러스는 대표적인 자연 숙주로
작은소피참진드기(Haemaphysalis
longicornis)가 있으며, 주로 중증열성혈소판감소증후군 바이러스에 감염된 매개성 진드기에게 물려 감염이 전파됨
- 중증열성혈소판감소증후군 바이러스에 의한 증상으로는 38℃
이상의 고열과 위장관계 증상에서부터 출혈성 소인, 다발성 장기부전, 백혈구 및 혈소판 감소 등과 같은 심각한 증상까지 다양하게
나타나며, 합병증으로 인해 사망에 이를 수 있음
- 중증열성혈소판감소증후군 바이러스는 2009년에 중국 후베이와
허난 지역에서 처음으로 확인 되었으며, 현재 일본, 대만, 베트남 등에서 다수 감염 사례가 발생하고 있으며, 국내에서도
2013년 첫 환자보고 이후 2022년까지 1,697명의 환자가 발생하고 317명이 사망하여 누적 치명률이 18.7%에 이르는 등 빠르게 확산하고 있음
- 현재 중증열성혈소판감소증후군에 효과적인 치료제 및 백신은
존재하지 않아, 진드기에게 물리지 않도록 예방하는 것이 가장 중요하며, 현재 증상에 따른 대증적 치료가 최선임
중증열성혈소판감소증후군(Severe
fever with thrombocytopenia syndrome)과 중증열성혈소판감소증후군 바이러스(SFTSV)
| 정의 |
중증열성혈소판감소증후군은 중증열성혈소판감소증후군 바이러스감염에 의한 중증 열성
바이러스성 질환 |
| 질병분류 |
제3급
감염병(질병코드: A93.8) |
| 병원체 |
페누이비리대과(Phenuiviridae)
반다바이러스속(Bandavirus)
중증열성혈소판감소증후군 바이러스(SFTS virus)
(음성 단일 가닥 RNA 분절형 바이러스)
|
|
| 주요 백신항원
|
Glycoproteins(Gc, Gn), Non-structural proteins
(NSs), Nucleocapsid protein (NP),
RNA
dependent RNA polymerase (RdRp)
|
| 병원소 |
작은소피참진드기(Haemaphysalis longicornis) |
| 감염경로 |
진드기 → 사람
|
중증열성혈소판감소증후군 바이러스를 지닌 진드기에 물려 감염 전파
|
| 사람 → 사람
|
환자의 체액과
혈액에 직접적으로 노출 시 사람 간 전파 가능
|
| 동물 → 사람
|
바이러스에 감염된
동물(개, 고양이 등)에 의한 전파 가능
|
| 국내발생 |
2013년에 제3급
법정감염병으로 지정되었으며, 2013년 첫 환자보고 이후 2022년까지 1,697명의
환자가 발생하고 317명이 사망함 |
| 국외발생 |
최초보고 |
2009년 중국
후베이 및 허난지역에서 처음으로 중증열성혈소판감소증후군 바이러스가 확인됨 |
| 발생동향 |
한국, 중국,
일본, 베트남, 대만, 미얀마, 태국, 호주, 뉴질랜드, 미국 등 광범위하게 분포함
|
| 위험지역 |
| 해외유입 |
| 잠복기 |
5-14일(9일)
|
| 임상 증상 |
-
매개성 참진드기에 물린 흔적은 확인이 쉽지 않으며, 증상이 나타날 즘에는
물린 흔적이 사라지기도 함
-
38℃ 이상의 고열과 위장관계 증상(오심・구토, 설사, 식욕부진 등)이
주요 증상임
-
출혈성 소인, 다발성 장기부전 및 사망에 이르기도 함
-
혈소판・백혈구 감소에 따른 출혈성 소인(혈뇨, 혈변 등) 발생
-
피로감, 근육통, 말 어눌・경련・의식 저하와 같은 신경학적 증상 동반
-
다발성 장기부전 동반 가능
-
백혈구 및 혈소판 감소, 혈청효소 이상 등
|
| 치명률 |
보통 12~47%,
2013~2022년 국내 기준 누적 치명률 18.7% |
| 진단 |
검체(혈액, 체액
등)에서 특이 유전자 검출(Real-time RT-PCR) 및 항체 검출 검사 |
| 치료 |
전 세계적으로
특화된 치료제 및 백신이 없어 증상에 따른 대증치료가 최선 |
| 예방 |
유행 지역 여행 시
진드기에 물리지 않는 것이 가장 중요함(모기 기피제, 긴 옷 등) |
출처
: 1) 중증열성혈소판감소증후군 진료지침 권고안, 질병관리청, 2016.
2) [제3급] 중증열성혈소판감소증후군, 부산광역시 감염병관리지원단, 2023.
3) 2022년 중증열성혈소판감소증후군 환자 및 사망자의 역학적 특성, 질병관리청, 2022. 재구성
국내외 연구개발 동향
1
중증열성혈소판감소증후군 바이러스(SFTSV)의 백신 및 치료제 개발 동향
중증열성혈소판감소증후군 바이러스(SFTSV)
감염증의 백신 연구개발
- 현재 중증열성혈소판감소증후군 바이러스의 승인된 백신 및
사람을 대상으로 한 백신 관련 임상시험
사례는 없으며, 개발되고 있는 SFTSV 동물모델인 유전적 변형 쥐 또는 흰 족제비를 대상으로
백신 후보군의 비임상시험이 진행되고 있음
- 아래의 표는 현재 플랫폼별로 개발되고 있는
중증열성혈소판감소증후군 바이러스의 백신 후보군을
나타낸 것으로 다양한 백신의 항원 및 플랫폼이 백신 개발에 활용되고 있음을 확인할 수 있음
중증열성혈소판감소증후군 바이러스(SFTSV)
감염증의 치료제 연구개발
- 현재 중증열성혈소판감소증후군 바이러스의 승인된 치료제는
존재하지 않으며, 비임상시험에서
광범위한 바이러스의 증식을 억제하는 항바이러스제를 중심으로 치료제 연구가 진행되고 있음
- 이외에도 이온채널 폐쇄를 통한 바이러스 감염 억제,
글루코코르티코이드, 혈장 그리고 단일클론
항체를 이용한 면역요법 등이 비임상시험에서 연구되고 있음
2
중증열성혈소판감소증후군(SFTS) 바이러스 감염증의 동물모델
중증열성혈소판감소증후군 바이러스(SFTSV)
동물모델의 종류
- 중증열성혈소판감소증후군 바이러스의 백신 및 치료제 개발을 위해
비임상 실험에서 활용되고 있는
대표적인 동물모델에는 마우스, 원숭이(영장류), 흰 족제비, 쥐, 햄스터, 고양이 등이 있음
- 그러나 비교적 최근에 발견된 SFTS 바이러스의 임상적 징후
및 증상을 재현할 수 있는 동물모델은
많은 추가적 연구가 필요한 실정임
- 적절한 동물모델을 선택하고 개발하려면 항바이러스제 및 백신
연구에 대한 동물의 적합성과 관련된
신중한 고려가 필요하며, 각 동물모델에서 SFTS 바이러스의 발병기전에 대해 자세히 이해하는 것이 중요함
- 그러나 현재, 인간의 SFTS 바이러스 복제 및 발병 기전이
명확하게 밝혀지지 않아, SFTS 환자를
대상으로 한 임상적 연구를 진행하여 바이러스의 감염 및 병원성과 관련된 분자적 메커니즘을 이해하는 것이 선행되어야 할 것임
- 선행 연구 이후 규명된 정보를 바탕으로 인간의 감염 과정과
유사한 양상을 보이는 중증열성혈소판
감소증후군 동물모델의 개발이 순조로워질 것임
임상시험 진행 주체 및 특허 개발 주체
1
해외
중국과학원(Chinese Academy of
Sciences)
- 중국과학원은 중화인민공화국의 국립 자연과학연구소이며 6개의
학술 부문(화학부, 정보기술과학부,
지학부, 생명과학 및 의학부, 수학물리학부, 기술과학부)으로 나뉨
- 100여 개의 연구소, 3개의 대학, 6만 9천 명의 정규직
직원, 대학원생 7만 9천 명을 보유한 세계 최대
규모의 연구기관이며, 매년 세계적인 연구기관으로 선정됨
- 중국과학원에서 개발 중인 SFTSV
백신‘rVSV-SFTSV’은 Recombinant Viral Vector-Based 백신 중
rVSV-Based 백신으로 약화된 vesicular stomatitis virus(VSV)에 SFTSV Gn/Gc 당단백질
유전자를 삽입함
- rVSV-SFTSV 백신은 SFTSV의 Gn/Gc 당단백질이
백신의 항원으로 작용하여 숙주에게 면역원성을
부여하며, 현재 면역 결핍 마우스 모델을 이용한 비임상시험을 완료하였으며, 백신의 면역원성에 대한
긍정적인 효과를 확인함
- 중국과학원은 rVSV-SFTSV 백신과 관련된 재조합 바이러스
벡터 백신 및 SFTSV 키메라 약독화 균주를
이용한 백신 관련 논문을 게재하고 특허를 출원하여 주요 출원인으로서 활발하게 연구를 진행하고 있음
일본국립감염병연구소(National
Institute of Infectious Diseases)
- 일본의 국립감염병연구소(NIID)는 후생노동성 산하 기관으로
3개의 바이러스학과, 2개의 세균학과, 감염병
감시센터, 에이즈 연구센터, 병원체유전체학센터, 인플루엔자 바이러스 연구센터, 병리학과... 곤충학과
등 총 22개의 학과로 구성됨
- 주로 연구하고 있는 전염병에는 인플루엔자, 조류인플루엔자,
홍역, 코로나19 등이 있으나 현재 일본에서도
빈번하게 발생하고 있는 SFTS에 관한 연구도 활발하게 이루어지고 있음
- 일본국립감염병연구소 무라야마 청사는 생물안전등급(BSL)
4등급의 연구 시설로 이곳에서 개발 중인
SFTSV 백신‘LC16m8-based SFTSV’은 Recombinant Viral Vector-Based 백신 중
rVAC-Based
백신으로 재조합 m8 균주에 SFTSV N, GPC 단백질 유전자를 삽입함
- LC16m8-based SFTSV 백신은 SFTSV의 N,
GPC 단백질이 백신의 항원으로 작용하여 숙주에게 면역 원성을 부여하며, 현재 면역 결핍 마우스 모델을 이용한 비임상시험을 완료한
상태로 백신의 면역원성에
대한 긍정적인 효과를 확인함
- 일본국립감염병연구소는 해당 백신과 관련된 논문을 게재하는 등
SFTSV 백신 연구를 활발하게 진행하고 있음
2
국내
서울대학교(Seoul National
University)
- 1946년 경성제국대학을 포함한 여러 관・공・사립
전문학교가 통합되면서 국립종합대학 ‘국립서울대학교’가
설립되었으며, 이후 ‘서울대학교’로 명칭이 변경됨
- 서울대학교는 1963년 의과대학 부설 풍토병 연구소를
설립하고 1997년 이후 감염병연구소로 명칭을
변경함
- 현재 전 세계적으로 코로나19를 포함한 신변종
감염질환의 출현과 아직도 완전한 치료 및 예방법 등이
개발되지 않은 결핵, 말라리아를 포함한 기존 감염질환의 확산으로, 최근 감염병의 병원성 기전 연구
및 백신, 치료제, 진단법 개발 등 감염병 위기 대응 연구 능력의 중요성이 확대되고 있음
- 이를 해결하기 위해 감염병연구소는 뛰어난 연구 역량을
가진 소속 연구원들의 감염질환 기초연구, 임상
연구 및 중개연구 등이 원활하게 진행되도록 지원함으로써, 기존의 만성감염 질환뿐만 아니라 미래에
발생할 신변종 감염질환에 대처할 수 있도록 학내 연구 기반을 구축하는 데 노력하고 있음
- 또한, 국내 감염병 연구기관, 관련 벤처기업, 해외
유관기관과 함께 감염병 연구에 대한 지원 및 협동을
통해 산학연이 모두 연계된 감염병 연구 네트워크를 구축하고 있음
- 서울대학교 감염병연구소에서 개발하고 있는 SFTSV
백신‘pSFTSV, pSFTSV-IL12’은 DNA based
백신의 일종으로 플라스미드에 SFTSV Gn/Gc, NP/NSs 단백질 유전자 및 IL-12 유전자를 삽입함
- ‘pSFTSV, pSFTSV-IL12’백신은
SFTSV의 Gn/Gc, NP/NSs 단백질이 백신의 항원으로 작용하여
숙주에게 면역원성을 부여하며, 추가로 삽입한 IL-12의 발현으로 백신의 면역원성을 강화하는 등의
전략을 통해 백신을 개발하고 있음
- 최근, 면역 결핍 마우스 모델을 이용한 비임상시험을
완료한 상태로 백신의 면역원성에 대한 긍정적인
효과를 확인함
- 서울대학교는 해당 백신과 관련된 논문 게재와 아단위
백신과 관련된 특허를 출원하는 등 주요 출원인으로서
활발하게 연구를 진행하고 있음
호흡기세포융합 바이러스 (RSV)
개요
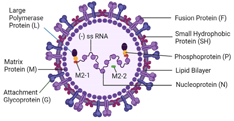
- 호흡기세포융합 바이러스(Respiratory Syncytial
Virus; RSV)는
Paramyxoviridae 과중 별도의
pneumovirus 속에 속하는 외피 비분절 음성 가닥 RNA 바이러스로,
급성 바이러스성 호흡기 질환을 일으키는 생물안전 4등급의 치명적인 병원체 중 하나임
- 호흡기세포융합 바이러스의 주요 숙주는 인간이며, 호흡기 비말을
통한 직접 전파 및 감염된 사람과의
직접적인 접촉, 분비물 혹은 오염된 물건의 접촉을 통한 간접 전파를 통해 전파됨
- 호흡기세포융합 바이러스 감염증은 콧물, 기침, 가래 등의
가벼운 증상에서부터 경련, 부정맥, 저나트륨 혈증,
신경학적 합병증, 폐렴 등과 같은 심각한 증상까지 다양하게 나타나며, 호흡기세포융합 바이러스는
전 세계적으로 매년 약 3,300만 건이 발생하여 약 16~19만 명이 사망하고 특히 1세 미만의 영아
전체 사망의 6.7%를 차지함
- 현재, 호흡기세포융합 바이러스의 치료는 입원한 소아 환자의
치료용으로 FDA 승인을 받은
Ribavirin이 활용되고 있으며, 보통 증상이 심해지면 임시 처방 용도로 사용하고 있음
- 백신의 경우 최초의 FDA 승인을 받은 GSK의
아렉스비(Arexvy)와 Pfizer의 아브리스보(Abrysvo)
등이 예방백신으로 존재하며, 예방용 항체로 능동면역 예방 접종 단클론 항체 Palivizumab,
Nirsevimab 등이 있음
호흡기세포융합 바이러스 감염증(Respiratory syncytial virus infection)과 호흡기세포융합
바이러스(Respiratory syncytial virus)
| 정의 |
호흡기세포융합
바이러스 감염에 의한 급성 호흡기 감염증 |
| 질병분류 |
제4급
감염병(질병코드: ICD-10 J02.8&B97.4, J03.8&B97.4,
J12.1, J20.5&B97.4, J21.0&B97.4) |
| 병원체 |
파라믹소바이러스과(Paramyxoviridae)
뉴모바이러스속(pneumovirus)
호흡기세포융합 바이러스(Respiratory Syncytial virus)
(음성 단일가닥 RNA virus)
|
|
| 주요 백신항원
|
Envelope
F(pre-F) protein |
| 병원소 |
사람 |
| 감염경로 |
사람 간 전파
|
-
호흡기 비말을 통한 직접 전파(약 반경 2미터 이내)
-
감염된 사람과 직접적인 접촉(감염성 에어로졸 흡입, 우발적 접종 및 상처난 피부, 점막에
감염성 물질로 인한 접촉)
-
감염된 사람의 분비물 혹은 오염된 물건의 접촉을 통한 간접 전파
|
| 국내발생 |
매년 10월쯤
시작하여 이듬해 3월까지 유행 |
| 국외발생 |
최초보고 |
1950년대 중반
최초 발견 |
| 발생동향 |
-
영유아에서 가장 중요한 호흡기 바이러스로 세계적으로 거의 모든 소아가 만
3세 이전 적어도
한 번 이상 감염되는 흔한 감염증
- 전
세계의 RSV 감염 예측 연구에 따르면, 2005년 5세 미만의 소아에서
약 3,400만 건의
RSV 감염, 최소 340만 건의 입원 예측
-
미국에서는 5세 이하의 영아에서 연평균 57,000명 이상이 RSV
감염증으로 입원하고 65세
이상의 고령에서 177,000명이 입원하여 14,000명이 사망하고 있음
|
| 위험지역 |
전 세계적으로 분포
|
| 해외유입 |
| 잠복기 |
2~8일(평균
5일) |
| 증상 |
-
영유아기 하기도 감염을 비롯한 전 연령층에서 다양한 호흡기 감염증을
일으키며, RSV에 의해 호흡기가
침범되는 정도는 다양함
-
연령이 증가하거나 감염이 반복될수록 상기도 감염의 형태 및 무증상이 많음
-
호흡기 이외의 중증 증상으로 경련, 부정맥, 저나트륨혈증, 신경 합병증
유발
(성인) 감기 정도의 경미한 증상(콧물, 재채기, 미열, 천명음, 코막힘, 쉰 목소리, 구토
(영유아) 콧물과 인두염으로 시작하여 1~3일 후 기침, 재채기, 미열 천명 증상이 나타나며, 심한 경우 모세 기관지염, 폐렴 발생
(고령자) 중증 진행 가능성 높음, 심장, 폐 또는 면역계 손상 환자들에서 발생 및 요양기관 집단 발생 가능성
|
| 치명률 |
대부분 자연
회복되나 고위험군*에서 RSV 폐렴 발생 시 사망률이 50% 이상
-
선천적 심장 기형아, 조산아, 개심술 직후의 소아(면역 저하 환자) 등
|
| 진단 |
검체(구인두 도말,
비인두 도말, 비강・비인두 흡인물, 기관지 폐포 세척액, 가래 등)에서 특이 유전자 검출(Real-time RT-PCR) |
| 치료 |
전 세계적으로
상용화된 특이치료제 없음(심한 RSV 감염증에 Ribavirin 투여 가능)
대증치료 : 기관지 확장제, 해열제 등 보존적인 치료 |
| 예방 |
-
상용화된 RSV 예방백신에는 GSK의 아렉스비(Arexvy) 및
Pfizer의 아브리스보(Abrysvo) 등이 최근 FDA 승인받음
-
또한, FDA 승인 능동면역 예방 접종 RSV 단클론
항체(Palivizumab, Nirsevimab) 등이 있음
-
기본적인 예방 방법으로 올바른 손 씻기, 기침 예절 준수, 씻지 않은
손으로 눈, 코, 입 만지지 않기 등
|
출처 : 호흡기세포융합 바이러스 감염증 발생 증가에 따른 예방・관리 강화 당부, 질병관리청, 2017,
제4급 급성호흡기감염증, 부산대학교병원 부산광역시 감염병관리지원단 2023, 재구성
국내외 연구개발 동향
1
호흡기세포융합 바이러스 감염증의 백신 및 치료제 개발 동향
호흡기세포융합 바이러스 감염증의 백신 연구개발
- 현재 호흡기세포융합 바이러스에서 FDA 승인을 받은 백신에는
글락소스미스클라인(GSK)이 개발한
서브유닛 백신 ‘RSVPre-F3/GSK3844766A(AREXVY)’과 화이자(Pfizer)의 서브유닛 백신 ‘RSVpreF
(Abrysvo)’ 등이 있으며, 각각 지난 2023년 5월 FDA로부터 고령의 노인이나 임산부에게 허가된
세계 최초의 RSV 백신임
- 이어 임상 3상 시험을 진행 중이던 Janssen의
Recombinant Vectors 기반 ‘Ad26.RSV.preF’
백신이 뒤를 이었으나, 앞서 언급한 FDA 승인받은 백신과 비교하여 차별화 가능성이 적다고 판단하여
임상 3상에서 개발을 중단함
- Novavax에서 개발 중인 Recombinant Nano particle 기반 백신 ‘PreF(RexVax)’는 현재, 임상
3상 시험에서 백신의 효과가 미미하여 개발에 난항을 겪고 있음
- 이외에도, 주요 백신 후보군에 Bavarian Nordic의 ‘MVA BN RSV’, GSK에서 추가로 개발 중인
RSV 백신 ‘RSVPreF3/GSK3888550A’ 등이 있음1)
- 또한, 영유아에서 RSV 백신으로 오랫동안 사용되고 있는 FDA 승인 RSV 면역예방제에는
‘Palivizumab(Synagis)’과 최근 사노피와 아스트라제네카에서 개발한 ‘Nirsevimab(Beyfortus)’
등이 있으며, 임상 3상 개발 중인 ‘Clesrovimab’ 등이 있음
- 1) Vaccine Brief 호흡기세포융합 바이러스 백신, 식품의약품안전처, 2022. 재구성
호흡기세포융합 바이러스 감염증의 치료제 연구개발
- 현재, 호흡기세포융합 바이러스의 승인된 치료제로는 대표적인
항바이러스제 Ribavirin이 유일하며, 임상 시험을 통해 개발되고 있는 치료제의 대부분은 RSV-FInhibitor로 작용하는
‘JNJ-53718678’, ‘RV521’, ‘AK-0529’, ‘BTA-C585’ 등이 있음2)3)
-
이어 RSV N Inhibitor로 작용하여 치료제로 개발되고 있는 ‘EDP-938’, ‘ALN-RSV01’ 등이 있음
- 2) Pharmacological targets and
emerging treatments for respiratory syncytial virus bronchiolitis,
Pharmacol Ther, 2021
- 3) The Future of Respiratory
Syncytial Virus Disease Prevention and Treatment, Infectious
Diseases and Therapy, 2021
2
호흡기세포융합 바이러스 감염증의 동물모델
호흡기세포융합 바이러스 동물모델의 종류
- 호흡기세포융합 바이러스의 백신 및 치료제 개발을 위해 비임상
실험에서 활용될 수 있는 동물모델에는
소, 쥐, 목화쥐, 족제비, 양, 침팬지 등이 있음
- 현재, 대부분의 RSV 비임상시험은 Mouse 또는
Cotton Rat 동물 모델을 대상으로 진행하고 있음
- 최근 호흡기세포융합 바이러스 감염 모델로 적합한 동물모델이
개발되고 있으며, 이러한 동물모델
중에서는 일부 유전적 변형을 통해 호흡기세포융합 바이러스와 임상적 징후 및 유사한 양상을 띠게
유도한 경우가 상당수 있음
- 위 동물모델은 각각 장단점이 분명하게 존재하나, 그중에서도
호흡기세포융합 바이러스의 영장류
모델로 가장 대표적인 Chimpanzee, Cynomolgus macaques, African green monkey 원숭이를
활용한 비임상 실험은 그 실험적 가치가 매우 높음
- 그 이유는 영장류가 인간과 가장 유사한 생리・면역학적 특성을
보이기 때문임
임상시험 진행 주체 및 특허 개발 주체
1
해외
Janssen(Johnson & Johnson)
- Janssen은 미국의 거대 제약회사로서 심혈관 및 신진대사,
면역학, 전염병 및 백신, 신경과학, 종양학,
폐고혈압 등 전 세계에 가장 큰 변화를 만들 수 있는 의학 분야에 중점을 두고 있음
- 얀센에서 개발 중인 호흡기세포융합 바이러스 백신
‘Ad26.RSV.preF’ 은 재조합 아데노바이러스 벡터
(Ad26) 기반 RSV stabilized pre-F 백신으로 pre-F가 항원으로 작용하여 RSV Genotype A, B형에
대한 숙주의 면역원성을 부여함
- Ad26 기반 벡터는 보조제를 필요로 하지 않아 우수한
안전성을 가지고 있어 상대적으로 면역력이 약한
노인을 대상으로 개발되고 있음
- 그러나 최근 얀센은 다수의 임상 3상 연구
중 ‘Ad26.RSV.preF’ 백신의 개발을 중단하였는데, 이는 최근
노년층을 대상으로 FDA 승인받은 GSK, Pfizer의 제품과 비교하여 차별화 가능성이 적다고 판단하고
연구・개발 투자 대비 환자들에게 괄목할 만한 잠재적 유익성을 제공할 수 있을 것으로 기대되는 치료제
개발에 더욱 집중하기 위한 전략적 선택의 하나로 RSV 백신 개발을 중단하기로 함
- Ad26.RSV.preF 백신은 현재 다수의 1, 2, 3단계
임상평가 완료 및 중단(대표 임상시험, NCT04908683 등)
- Title : A Study of an
Adenovirus Serotype 26 Pre-fusion Conformation-stabilized F
Protein(Ad26. RSV. preF) Based Respiratory Syncytial Virus(RSV)
Vaccine in the Prevention
of Lower Respiratory Tract Disease in Adults Aged 60 Years and
Older(EVERGREEN)
- Collaborator: No information
provided
Pfizer
-
화이자는 미국의 세계 최대 연구 기반 제약회사로 면역학, 염증학, 종양학, 심혈관계 질환, 대사성 질환, 신경 질환 및 통증,
백신 등과 같은 분야를 연구개발 우선순위로 설정하여 연구를 진행하고 있음
-
이외에도 화이자는 희귀병 및 유전병 연구에 대한 지속적인 관심을 기울이고 있으며 혁신적인 치료제 및 백신 개발을 추진하고 있음
-
최근 화이자는 bivalent pre-F subunit‘RSVpreF(Abrysvo)’RSV 백신을 개발하였으며, pre-F가
항원으로 작용하여 RSV Genotype A, B형에 대한 숙주의 면역원성을 부여함
-
본 백신은 18~49세 성인을 대상으로 한 1/2상 연구에서 우수한 면역원성과 안전성을 보여주었으며,
후속 임상 2b 연구에서는 RSV-preF 백신으로 인한 RSV Genotype A, B 모두에 대한 중화항체가
태반을 통해 태아에게 효과적으로 전달되었고, 임신 24~36주 사이의 임산부에서 특별한 안전성 문제도
나타나지 않음
-
따라서, 화이자의 아브리스보는 60세 이상의 고령 환자는 물론 임신 32~36주 사이의 임산부를 대상으로
능동면역을 일으켜 출생부터 생후 6개월까지 영아에서 RSV로 인한 하기도 호흡기 질환의 예방 용도로
FDA 승인받은 최초의 영아 보호를 위한 임산부 대상 상용화 백신으로 GSK의 아렉스비에 이어 2번째로
FDA 승인받은 RSV 백신임
-
RSVpreF(Abrysvo) 백신은 현재 다수의 2, 3상 임상평가 진행 및 완료(대표 임상시험, NCT05096208 등)
- Title : Clinical Lot
Consistency for RSVpreF in a Population of Healthy Adults 18 to ≤49
Years of Age
- Collaborator: No information
provided
GSK(GlaxoSmithKline)
-
GSK는 일반 의약품, 특수 의약품 및 백신의 개발, 제조 및 상용화에 주력하고 있는 거대 제약 및 의료
회사이며, 중추신경계 질환, 대사 질환, 심혈관 질환, 항박테리아, 피부 질환 및 희귀질환 등의 질병
치료를 위한 약물을 개발하고 있음
-
GSK의 백신과 의약품의 3분의 2는 HIV, RSV, Meningococci, Hepatitis B 및 항생제 내성 박테리아에
의한 전염병 등 감염병 연구개발에 집중하여 전 세계 공중 보건에 대한 부담을 완화하고 있음
-
GSK에서 개발하여 RSV 백신으로서 FDA 승인받은 최초의 호흡기세포융합 바이러스 RSV 백신인
‘RSVPre-F3/GSK3844766A(AREXVY)’는 재조합 subunit pre-F(RSVPreF3) combined
with
GSK AS01E adjuvant 백신으로 pre-F3가 항원으로 작용하여 RSV Genotype A, B형에 대한 숙주의
면역원성을 부여함
-
본 백신은 60세 이상의 고령 참가자에 대한 RSV 하기도 감염 예방 효능이 82.6%로 높게 나타났으며, RSV A 및 B
균주에 걸쳐 일관되게 높은 백신 효능이 관찰됨
-
이에 GSK의 아렉스비는 FAD로부터 60세 이상의 성인에서 RSV에 의한 하기도 호흡기 질환 예방을 위한 고령자 전용 백신으로
FDA 승인을 받음
-
GSK는 RSVpre-F3 subunit 백신에 관한 호흡기세포융합 바이러스 백신 관련 특허를 출원하여 주요 출원인으로서 활발하게
연구를 진행하고 있음
Moderna
-
Moderna는 지난 2010년 창립한 생명공학 기업으로, 새로운 수준의 mRNA(messenger RNA) 의약품개발을 선도하고
있음
-
mRNA 플랫폼을 활용한 다양한 감염성 적응증에 대한 백신을 개발하고 있으며, 특히 수두 대상포진
바이러스 백신(mRNA 1278), 거대세포 바이러스 백신(mRNA 1443), 앱스타인바 바이러스 백신
(mRNA 1195), 지카바이러스 백신(mRNA 1893), 치쿤구니야 바이러스 백신(mRNA-1944,
VAL-181388), 호흡기세포융합 바이러스 백신(mRNA-1345) 등을 개발하고 있음
-
모더나에서 개발 중인 호흡기세포융합 바이러스 백신‘mRNA-1345’는 mRNA sequence encoding
stabilized pre-F를 lipid nano particles(LNPs)로 전달하는 Nucleic acid 백신으로
pre-F가 항원으로
작용하여 RSV Genotype A, B형에 대한 숙주의 면역원성을 유도함
-
최근 임상 3상 효능 시험에서 노인의 RSV 하기도 질환에 대해 83.7%의 백신 효능을 입증하면서 1차
유효성 평가변수를 입증하는 등 긍정적인 결과를 보임
-
이에 모더나는 유럽의약품청(European Medicines Agency), 스위스메딕(Swissmedic) 및 호주 식약처
(Therapeutic Goods Administration)에 연구용 RSV 백신(mRNA-1345)에 대한 판매 승인 신청서를
제출하고 미국 FDA에 생물학적 제제 허가신청을 순차적으로 진행하고 있음
-
모더나는 mRNA 백신 플랫폼을 기반으로 한 RSV pre-F 백신(mRNA-1345)에 관한 호흡기세포융합
바이러스 백신 관련 특허를 출원하여 주요 출원인으로서 활발하게 연구를 진행하고 있음
Bavarian Nordic
-
Bavarian Nordic는 감염성 질환 및 암 면역요법용 백신의 개발, 제조 및 상업화에 중점을 두고 있는 덴마크의 백신 전문 기업임
-
바바리안 노르딕에서 개발 중인 호흡기세포융합 바이러스 백신‘RSV-MVA-BN’은 MVA(Modified
Vaccinia Ankara)-BN 플랫폼을 기반으로 한 Recombinant vectors 백신으로 RSV의 F, G(A & B
subtype) and N, M2가 항원으로 작용하여 RSV Genotype A, B형에 대한 숙주의 면역원성을 유도함
-
바바리안 노르딕은 MVA-BN 플랫폼을 기반으로 한 다수의 RSV 백신 관련 특허를 출원하여 주요
출원인으로서 활발한 연구를 진행하였으나, 최근 바바리안 노르딕은 본 백신의 60세 이상 성인을 대상으로
벌인 RSV MVA-BN 임상 3상 시험에서 RSV로 인한 하기도 질환 예방에 관한 1차 평가 지표가 충족
되지 않았고 최종적으로 백신의 효능 기준을 충족시키지 못해 임상 3상 시험이 실패했음을 언급하면서
RSV 백신 개발 프로그램을 중단하기로 함
Novavax
-
노바백스는 미국의 거대 생명공학 회사로 심각한 감염병에 대한 혁신적인 백신을 만드는 기업임
-
노바백스에서 개발 중인 호흡기세포융합 바이러스 백신‘ResVax™’는 aluminum adjuvanted RSV
pre-F 재조합 nano particle 백신으로 pre-F가 항원으로 작용하여 RSV Genotype A, B형에 대한
숙주의 면역원성을 부여함
-
‘ResVax™’는 산모의 예방 접종을 통해 영유아를 대상으로 하는 RSV 백신으로 개발되고 있으나, 대규모
임상 3상 시험에서 연구 목표(RSV 하기도 감염의 예방) 달성에 실패하는 등 좋지 않은 결과를 보이고 있음
-
그러나, RSV LRTI 입원 비율에 대한 효능이 관찰되어 다른 탐색적 평가변수와 사후 분석에서 전반적인
건강 개선 효과가 확인됨
-
이에 노바백스는 다음 단계로 미국 및 유럽 규제 당국들과 이 자료를 검토하기 위한 회의를 시행하고
승인을 위한 판로 개척에 노력하고 있음
-
ResVax™ 백신은 현재 임상시험에서 RSV F라는 이름으로 다수의 2, 3단계 임상평가 진행 및 완료
(대표 임상시험, NCT02624947 등)
- Title : A Study to Determine the Safety and Efficacy of the RSV F Vaccine to Protect
Infants Via Maternal Immunization
- Collaborator: Bill and Melinda Gates Foundation
인플루엔자 바이러스
개요
- 인플루엔자 바이러스(Influenza virus)는
Orthomyxoviridae 과에 속하는 외피로 둘러싸인 음성 단일가닥 RNA 바이러스로, 감염된 환자 및 동물의 비말(침방울), 접촉
또는 분비물에 의해서 전파가 이뤄짐
- 인플루엔자 바이러스는 인수공통 급성 호흡기 감염병의 일종으로 제 4급 감염병의
치명적인 병원체 중 하나임. 또한, 인플루엔자 바이러스는 핵산의 유형에 따라 A,
B, C형으로 나뉘며 각기 다른 생물학적 특징을 보이고 대표적인 자연 숙주로 돼지, 조류 등이 있음
- 인플루엔자 바이러스에 의한 전형적인 임상적 증상은 갑작스러운 발열(38-40℃), 두통, 근육통에서부터 흉통, 안구통, 복통 경련 등의
증상에 이르기까지 다양한 증상이 나타남
- 우리나라에서는 인플루엔자 바이러스에 대해 1997년 인플루엔자 표본감시를 도입하고 2015년 인플루엔자 입원 감시를 도입하는 등 매주 역학조사를 진행하고 있음
- 전 세계에서 계절성 인플루엔자는 매년 세계인구의 약 5~15%가 감염되고 3~5백만명이 중증으로 진행,
29~65만 명이 사망하는 전염성이 강한 급성 호흡기 감염병이며, 20세기에 3회의 인플루엔자 대유행(스페인 인플루엔자(A/H1N1)),
아시아 인플루엔자(A/H2N2), 홍콩 인플루엔자(A/H3N2) 등이 발생하고 21세기에는 2009 인플루엔자(A/H1N1)에 의한 대유행이 발생함
- 인플루엔자 바이러스 감염증에 특이적인 백신 및 치료제가 개발되어 FDA 승인을
받았으나, 매년 유행하는 인플루엔자가 달라지고 항원 소변이가 일어나는 만큼 권장되는 백신이 매번 달라지며, 이에 새로운 백신 생산 및 접종이 필요함
- 1) 이하, “인플루엔자 바이러스(H5N1)“, ”인플루엔자(H5N1)”, “H5N1 바이러스” 등으로 표기함
인플루엔자(Influenza)와 인플루엔자 바이러스(Influenza virus)
| 정의 |
인플루엔자 감염증은 인플루엔자 바이러스에 의해 매개되는 급성 호흡기 질환 |
| 질병분류 |
제4급 감염병(질병코드: J10.0~J11.8) |
| 병원체 |
오르토믹소바이러스과(Orthomyxoviridae)
인플루엔자 바이러스(Influenza virus)
(음성 단일가닥 RNA 바이러스)
|
|
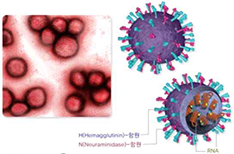
| 병원체의 분류 및 특징
|
인플루엔자 바이러스는 핵산의 구성에 따라 A, B, C 및 D형으로 분류되는데 표면
항원인 Hemagglutinin(HA)과 Neuraminidase(NA)에 의해 아형(subtype)이 결정됨
-
(A형 인플루엔자) 항원변이가 빈번하게 발생하고 사람뿐만 아니라 돼지, 조류 등 동물을 감염시킴
-
(B형 인플루엔자) A형보다는 항원 변화가 적으며, 면역학적으로 안정적이고 사람이 유일한 숙주로 Victoria와 Yamagata의
두 가지 B형 인플루엔자 계통이 사람에게서 확인됨
-
(C형 인플루엔자) 숙주로 사람과 돼지를 주로 감염시키며, 대부분 무증상이고 인플루엔자 유행과는 연관이 없음
-
(D형 인플루엔자) 숙주로 소에게 영향을 미치며, 사람을 대상으로 감염시키거나
질병을 일으키지는 않는 것으로 나타남
|
| 주요 백신항원
|
Hemagglutinin(HA), Neuraminidase(NA)
|
| 병원소 |
사람, 돼지, 조류 등 |
| 감염경로 |
사람 → 사람
|
-
(비말감염) 환자가 기침, 재채기할 때 분비되는 호흡기 비말을 통해 주로 전파됨
-
(접촉감염) 바이러스에 오염된 물건이나 환경을 만진 후 눈, 코, 입 등을 만지는 경우 접촉감염 가능
-
(분비물) 감염 동물의 분비물에 직·간접 접촉 시 감염이 가능
|
| 동물 → 사람
|
| 국내발생 |
인플루엔자 바이러스는 현재 법정감염병 4등급으로 1997년 인플루엔자 표본감시를
도입하고 2015년 인플루엔자 입원 감시를 도입하는 등 매주마다 역학조사를 진행하고 있음 |
| 국외발생 |
최초보고 |
인플루엔자 범유행에 관한 신뢰할 만한 첫 기록은 1580년에
있었고, 그 후 모든 독감 주기는 10~30년마다 발생함 |
| 발생동향 |
인플루엔자는 매년 세계 인구의 약 5~15%가 감염되고 3~5백만 명이 중증으로 진행,
29~65만 명이 사망하는 전염성이 강한 급성 호흡기 감염병이며, 세계적으로 분포함
|
| 위험지역 |
| 해외유입 |
| 잠복기 |
1~4일(평균 2일)
|
| 임상 증상 |
-
전신증상 및 호흡기 증상이 갑자기 시작됨
- 전형적인 증상(50%에서 나타남)은 갑작스러운 발열(38~40℃), 두통, 근육통, 피로감 등의 전신증상이 가장 빨리 나타나고 2~3일 정도 지속
- 전신증상과 함께 인후통, 콧물, 코막힘, 기침 등의 호흡기 증상 동반
- 흉통, 안구통, 복통, 경련 등의 증상이 나타남
-
임상 증상의 지속 기간은 5~15일 정도이며, 주로 호흡기 증상이 가장 늦게까지 유지됨
-
소아에서는 구토, 오심, 설사 등의 소화기 증상 동반
|
| 치명률 |
WHO 자료에 따르면 0.03~0.07%, CDC의 자료를 기반으로 0.06~0.18%로 추정 |
| 진단 |
(혈액, 체액 등)에서 특이 유전자 검출(Real-time RT-PCR) 및 항원 검출 검사, 다양한 진단 키트 등 |
| 치료 |
국내에서는 중증도에 따라 대증치료에서부터 항바이러스제(Oseltamivir, Zanamivir,
Peramivir 등) 투여 |
| 예방 |
매년 권장 백신주(유행 예측주)가 절기별로 달라 매년 새로운 백신 생산 및 접종이
필요하나 보통 4가 인플루엔자 불활성화 백신을 투여로 예방 접종함 |
국내외 연구개발 동향
1
인플루엔자 바이러스 백신 및 치료제 개발 동향
인플루엔자 바이러스 감염증의 백신 연구개발
- 인플루엔자 바이러스 백신은 전 세계적으로 불활화, 약독화 및 재조합 백신 등
3가지 유형의 플랫폼을 기반으로 한 백신이 주로 개발되고 있음
- 매년 가장 적절한 인플루엔자 백신을 채택하기 위해 WHO와 이해관계자 간의
적합한 백신 권장을 위한 회의가 개최되고 있음
- 현재 다양한 기관에서 3가 및 4가 백신을 제조하고 있으며, 수년간 세 가지 다른
인플루엔자 바이러스에 대한 보호를 제공하기 위해 3가 백신이 개발됨
- 보통 A/B형 인플루엔자 바이러스가 포함되어 있으며, 아래의 표는 현재 공식적으로
승인된 인플루엔자 백신을 나타낸 것으로 HA(Hemagglutinin)을 주로 표적25)으로 함
- 한편, 현재 미국 FDA의 승인을 받은 주요 H5N1 백신으로는 GSK의 Adjupanrix,
GSK 자회사 ID Biomedical Corporation of Quebec의 Q-Pan H5N1, Seqirus, Inc의
Audenz 등이 있음
인플루엔자 바이러스 감염증의 치료제 연구개발
- 현재 여러 국가에서 인플루엔자 치료를 위해 4가지 종류의 항바이러스 약물이
승인되었으며, 종류에는 adamantanane, Neuraminidase inhibitor, membrane fusion
inhibitor, RNA-dependent RNA polymerase 등이 있음
- 이 중 adamantanane 및 Neuraminidase inhibitor만 유럽 연합 및 미국에서 사용이
허가됨. 그러나, 현재 순환하는 인플루엔자(계절성 포함) 바이러스 대부분은
adamantanane 유도체에 대한 내성이 있어 권장되지 않고 있음
- 결과적으로 아래와 같은 Neuraminidase inhibitor에 속하는 Oseltamivir(Tamiflu),
Zanamivir(Relenza), Peramivir(Rapivab) 등이 있으며, 최근에 개발된 Baloxavir
marboxil(Xofluza)는 20년 만에 나온 새로운 기전의 인플루엔자 치료제로 인플루엔자 바이러스의 복제에 필수적인 중합효소 산성 엔도뉴클레아제
단백질(Polymerase acidic endonuclease)을 억제해 바이러스 복제의 초기 단계부터 진행을 막음
- 추가로, H5N1 바이러스에 감염되면 WHO 및 CDC 지침에 따라 Oseltamivir(Tamiflu)를 권장함
2
인플루엔자 바이러스 감염증의 동물모델
인플루엔자 바이러스 동물모델의 종류
- 현재 인플루엔자 바이러스의 백신 및 치료제 개발을 위해 활용되고 있는 대표적인 동물모델에는
원숭이(영장류), 흰족제비, 마우스(형질전환 등), 기니피그, 햄스터, 닭, 돼지, 고양이 등이 있음
- 실질적으로는 편의성을 고려하여 마우스가 가장 일반적으로 사용되고 있는데 흰족제비를 사용하면
인플루엔자 전염뿐만 아니라 백신 및 치료 효능에 관한 연구에 매우 적합함
- 또, 기니피그, 돼지, 고양이, 개, 비인간 영장류를 포함한 동물모델도 인플루엔자
바이러스의 병인을 이해하는 데 큰 도움이 됨
- 이처럼 각 동물모델에는 뚜렷한 장단점이 있으며, 특정 연구 주제를 위한 적합한
동물모델의 선택이 중요2)함
- 다른 유행성 감염병의 동물모델과 같이 영장류 모델을 활용한 비임상 실험은
영장류가 인간과 가장 유사한 생리·면역학적 특성을 보이기 때문에 실험적 가치가 매우 높음
- 2) Animal Models for Influenza Research: Strengths and Weaknesses, Viruses, 2021
국내외 개발주체 동향
ID-Biomedical Corporation of Quebec
- ID-Biomedical Corporation of Quebec는 GSK의 자회사이며, 백신 제품 개발에
전념하고 있는 생명공학 회사로 캐나다와 미국에 있는 시설에서 백신 연구, 개발, 제조, 판매하고 있음
- ID-Biomedical Corporation of Quebec은 인플루엔자 A 및 B형에 대한 예방을
위해 사용되는 ‘FluLaval Quadrivalent’ 계절 독감 백신을 개발 및 판매하고 있으며, 고병원성 조류 인플루엔자 백신(H5N1)에 대한 백신도 연구개발을 진행하고 있음
- 지난 2013년 ID-Biomedical Corporation of Quebec은 H5N1 인플루엔자의 예방을
위해 ‘Influenza A (H5N1) Virus Monovalent Vaccine, Adjuvanted(AS03-adjuvanted
vaccine)’ 백신을 개발하였음. 이 백신은 Q-Pan H5N1라고도 하는데, FDA 승인을
받은 미국 최초의 보조제(AS03) 활용 독감 백신임
Sanofi pasteur
- Sanofi pasteur(사노피)는 프랑스의 다국적 제약회사의 백신 사업부로 주요 감염병에 대한 백신 개발에 집중하고 있음
- 사노피파스퇴르는 다양한 인플루엔자 백신을 개발 및 제품으로 출시하였으며, 대표적으로 FLUBLOK® QUADRIVALENT, FLUZONE® HIGH-DOSE QUADRIVALENT
등의 계절성 인플루엔자의 예방접종에 활용되는 백신을 개발하였으며, 해당 백신은 인플루엔자 A 및 B 균주로 발생하는 질병에 대한 예방 효과를 보임
- 또, 사노피파스퇴르는 고병원성의 조류 인플루엔자 H5N1의 예방을 위해 지난
2007년 ‘Influenza Virus Vaccine, H5N1, is an inactivated monovalent influenza virus vaccine’을 세계 최초로 FDA 승인 받음
- 사노피파스퇴르는 인플루엔자 바이러스 특성상 새롭게 유행하고 있는 변종에 면역반응을 유도할 수 있는 백신을 연구하는 등 변종 예방을 위해 다양한 플랫폼
(RNA based, Inactivated based, Subunit based)의 인플루엔자 백신 관련 임상 연구를 다수 수행하고 있음
Academia sinica
- Academia Sinica는 수학 및 물리과학, 생명과학, 인문사회과학에 관한 연구를 주로 하는 대만 국립학술기관으로,
인플루엔자 및 기타 바이러스 감염에 대한 단백질 백신을 개발하고 있음
- Academia Sinica는 HA 기반 단백질 백신, 글리코실화된 HA 기반으로 광범위한
중화항체(bnAbs)를 유도하는 인플루엔자 백신을 개발하였으며, 이는 OPKO
Health, Inc. 및 RuenHuei Biopharmaceuticals, Inc.에서 공동으로 개발 중임
- 최근에는 인플루엔자 바이러스에 대한 변종(H5N1)에 면역반응을 유도할 수 있는
백신을 개발하는 등 변종 예방을 위한 백신 관련 특허 출원 및 임상 연구을 활발하게 진행하고 있음
Seqirus, Inc
- Seqirus(세퀴러스)는 세계 최대의 인플루엔자 백신 회사 중 하나이며, 다양한 제품의 인플루엔자 백신 Afluria®
; Quadrivalent, Inactivated Quadrivalent Influenza
Vaccine (split viron) / Agrippal®
; Influenza Vaccine (surface antigen inactivated)
/ Fluad®
; Inactivated Influenza Vaccine Adjuvanted / Flucelvax®
; Quadrivalent
Inactivated Influenza Vaccine 등을 개발하였으며 판매하고 있음
- 최대 규모의 인플루엔자 백신 회사에 걸맞게 다양한 계절 독감 백신을 개발 및
판매하고 있으며, 일부 국가에서 사용될 수 있는 백신은 조금씩 상이함
- 또, 고병원성 조류 인플루엔자인 H5N1을 표적으로 한 Influenza A (H5N1)
Monovalent Vaccine, Adjuvanted, Inactivated 백신을 지난 2021년 FDA 승인 받았으며, 현재 시중에서‘AUDENZ®’제품명으로 판매되고 있음
- 인플루엔자 특성상 새롭게 유행하고 있는 변종에 면역반응을 유도할 수 있는
백신을 연구하는 등 변종 예방을 위한 백신 관련 임상 연구를 활발하게 진행하고 있음
코로나 바이러스 감염증-19 (COVID-19)
개요
- 코로나19 바이러스는
Coronaviridae 아과 Betacoronavirus 속에 속
하는 외피로 둘러싸인 양성 단일가닥 RNA 바이러스로, 코로나19 바이러스에 감염
된 환자의 비말(침방울) 또는 접촉을 통해 전파가 이뤄짐
- 코로나19 바이러스는 인수공통 호흡기 증후군의 일종으로 생물안전 4등급의 치명적인 병원체 중 하나임. 또한, 코로나19 바이러스의 대표적인 자연 숙주로 래트, 마우스, 닭, 칠면조, 여러 조류, 소, 야생반추동물, 개, 고양이 등이 있으며, 집 주변에 존재하는 포유동물들이 코로나19 바이러스의 중간숙주 역할을 할 수 있음
- 코로나19 바이러스에 의한 임상적 증상은 무증상, 발열(37.5℃ 이상)에서부터 호흡 곤란, 폐렴, 천식, 심폐질환, 인후통 등과 같은 증상에 이르기까지 다양하게 나타나며, 합병증으로 사망에 이를 수 있음
- 우리나라에서 코로나19 바이러스는 2020년 1월 국내 첫 코로나19 바이러스 환자 발생을 시작으로 2023년 6월 기준 총 32,131,606명(인구 10만 명당 31.43명), 35,017명이 사망함
- 전 세계 기준 2019년 12월 중국 우한에서 원인 미상의 폐렴 환자 44명을 시작으로
2023년 8월 기준 전 세계에서 총 769,483,224명의 환자가 발생하고 6,940,871명이 사망함
- 코로나19 바이러스는 단순한 의료적 차원의 문제가 아닌 사회경제적으로 커다란 변화를 초래하였으며, 이에 각국의 협력과 새롭게 등장한
mRNA 기반의 혁신적인 백신 기술에 의해 지금까지 세계적으로 창궐한 감염병 중에서는 이례적인 속도로 코로나19 바이러스 특화 백신이 개발되었으며, 코로나19 바이러스에 비교적 효과가 있는 항바이러스제 개발에 성공하고 곧바로 예방접종 및 치료를 시작함
- 그러나, 코로나19 바이러스는 다양한 돌연변이에 의한 변종이 지속적으로 출현하고
있어 국제적인 감시 체계 구축의 필요성이 대두되고 있음. 아래의 표는 코로나19
바이러스와 증상에 관한 기본적인 정보를 나열함1)2)
- 1) 서울특별시 감염병 주간 소식, 서울특별시 시민건강국 감염병연구센터, 2023.
- 2) [제4급] 급성 호흡기 감염증 – 사람 코로나바이러스 감염증, 부산대학교병원 부산광역시 감염병관리지원단, 2023.
코로나바이러스감염증-19(Coronavirus disease 19; COVID-19)과
코로나19 바이러스(SARS-CoV-2)
| 정의 |
코로나바이러스감염증-19는 코로나19 바이러스 감염에 의한 호흡기 증후군 |
| 질병분류 |
제4급 감염병(질병코드: U07.1) |
| 병원체 |
코로나비리데과(Coronaviridae)
베타코로나바이러스속(Betacoronavirus)
코로나19 바이러스(SARS-CoV-2)
(양성 단일가닥 RNA 바이러스)
|
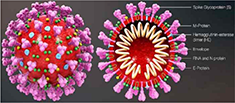
|
| 주요 백신항원
|
Spike protein(S), Envelope protein(E), Nucleocapsid protein(N), Membrane glycoprotein(M), Non-structural protein(NSP)
|
| 병원소 |
사람, 박쥐 ,래트, 마우스, 닭, 여러 조류, 소, 야생반추동물, 개, 고양이 등 |
| 감염경로 |
사람 → 사람
|
-
(비말감염) 감염자가 기침, 재채기, 말하기, 노래 등을 할 때 발생한 비말을 다른 사람이 밀접 접촉(주로 2m 이내)하여 발생
-
(표면접촉) 공기 등을 통해서도 전파가 가능하나, 공기전파는 의료기관의 에어로졸 생성 시술,
밀폐된 공간에서 장시간 호흡기 비말을 만드는 환경 등 특정 환경에서 제한적 전파
|
동물 → 사람
가능성 낮음
|
| 국내발생 |
코로나바이러스감염증-19는 팬데믹 초기 제1급 법정감염병으로 지정되었으나, 차츰
그 양상이 완화됨에 따라 하향 조정되어 2023년 말 현재 제4급 감염병으로 지정됨. 국내에서는 2020년 1월 첫 환자가 발생한 이후 2023년 6월 기준
총 32,131,606명(인구 10만 명당 31.43명)에 이르고, 35,017명이 사망함 |
| 국외발생 |
최초보고 |
2019년 12월 중국 우한에서 원인 미상의 폐렴 환자가 발생하였으며, 2020년 1월 중국 보건부에서 새로운 타입의 코로나19 바이러스를 분리함 |
| 발생동향 |
세계보건기구(WHO)에서 코로나19 바이러스를 팬데믹으로 선언한
만큼 전 세계적으로 대유행하였으며, 2023년 8월 기준 전 세계적으로 총 769,483,224명의 환자가 발생하고 6,940,871명이 사망함
|
| 위험지역 |
| 해외유입 |
| 잠복기 |
1-14일(평균 5~7일)
|
| 임상 증상 |
-
코로나바이러스감염증-19의 임상 증상은 무증상(확진 환자의 26.7%), 경증, 중등
증, 중증까지 다양함
- 환자의 약 80%는 경증, 14%는 중증, 5%는 치명적임
- 중증도는 고령, 기저질환의 유무와 관련이 있음
-
주요 증상으로는 발열(37.5℃ 이상), 기침, 호흡곤란, 오한, 근육통, 두통, 인후통, 후각·미각소실 등
- 그 외 피로, 식욕감소, 가래, 소화기 증상(오심, 구토, 설사 등), 혼돈, 어지러움, 콧
물이나 코막힘, 객혈, 흉통, 결막염, 피부 증상 등 다양하게 나타남
-
고위험군(65세 이상의 노인, 기저질환자, 암 환자, 비만, 장기이식, 흡연자 등)
|
| 치명률 |
전 세계 치명률은 지역, 인구집단 연령 구조, 감염 상태 및 기타 요인에 의해 다양하나 2023년 9월 기준 치명률은 약 1%에 달함 |
| 진단 |
검체(혈액, 체액 등)에서 특이 유전자 검출(Real-time RT-PCR) 및 항원 검출 검사, 다
양한 진단 키트 등 |
| 치료 |
중증도에 따라 대증치료에서부터 항바이러스제(베클루리주, 팍스로이드, 라게브리오
등) 투여 |
| 예방 |
국내 도입된 코로나19 바이러스 백신 6종(바이러스벡터 백신 2종(아스트라제네카,
얀센), mRNA 백신 2종(화이자, 모더나), 합성항원 백신 2종(노바백스, 스카이코비원)) 및
오미크론 변종에 대한 화이자, 모더나의 2가 백신(Bivalene Vaccine) 등의 접종을 통한 예방 |
국내외 연구개발 동향
1
코로나바이러스감염증(COVID-19) 백신 및 치료제 개발 동향
코로나바이러스감염증-19의 백신 연구개발
- 코로나19 바이러스는 전 세계적인 감염 확산으로 인해 역대 세 번째로 팬데믹을
공식 선언한 바이러스임에도 불구하고 이례적인 속도로 효과가 뚜렷한 특이적 백신이 개발됨
- 이는 RNA 바이러스 감염병의 특징인 비정상적이고 빠른 돌연변이에 대응할 수
있는 혁신적인 mRNA 백신 플랫폼(mRNA 백신)을 개발한 모더나, 화이자 그리고
바이오엔텍 등 글로벌 제약사의 기여에 의한 것임
- 이외에도 코로나19 바이러스의 스파이크 단백질을 백신의 항원으로 활용한 바이러스벡터 백신, 단백질 서브유닛 백신 및 불활성화 백신 등
다양한 백신 플랫폼을 기반으로 한 백신이 승인 및 출시됨
- 현재 코로나바이러스감염증-19의 치료제는 매우 다양한 표적을 타겟으로 개발되고 있으나, 단일 부위를 표적으로 한 약물의 경우 RNA 바이러스의 빠른 무작위
돌연변이에 의한 약물 내성 진화에 취약18)하다는 문제점을 가짐
- 따라서, 수많은 새로운 코로나19 바이러스 변종의 구조 기반 약물 치료 효과를
추가로 분석해야 할 필요가 있으며, 동시에 코로나19 바이러스의 수명주기에 필수적인 단백질과 숙주 단백질의 보존 결합 부위 및 여러 핵심 타겟을 표적으로한 약물 개발이 더 이상적인 치료제 개발 방법일 수 있음
2
코로나바이러스감염증(COVID-19)의 동물모델
코로나19 바이러스 동물모델의 종류
- 현재 코로나19 바이러스의 백신 및 치료제 개발을 위해 활용되고 있는 대표적인
동물모델에는 원숭이(영장류), 흰족제비, 시리안 햄스터, 마우스(형질전환 등), 고양이 등이 있음
- 비교적 최근 코로나19 바이러스가 팬데믹으로 창궐하여 이에 짧은 기간 동안
코로나바이러스감염증-19의 감염모델로 적합한 동물모델이 개발되고 있으며, 일부
마우스 모델에서 인간의 ACE2 수용체를 발현하는 유전적 변형19)을 통해 인간의
코로나바이러스감염증-19의 임상적 징후와 유사한 양상을 띠게 유도한 연구가 상당수 진행되고 있음
- 위 동물모델들은 각각 장·단점이 분명하게 존재하고 개발 중이지만 그중에서도
코로나19 바이러스의 영장류 모델로 가장 대표적인 Cynomolgus macaques, Rhesus
macaques, African Green Monkeys, Baboons 원숭이를 활용한 비임상 실험은 그
실험적 가치가 매우 높음
- 그 이유는 영장류가 인간과 가장 유사한 생리·면역학적 특성을 보이기 때문임
국내외 개발주체 동향
Pfizer
- 화이자는 미국의 세계 최대 연구 기반 제약회사로 면역학, 염증학, 종양학, 심혈관계 질환,
대사성 질환, 신경 질환 및 통증, 백신 등과 같은 분야를 연구개발 우선순위로 설정하여 연구를 진행하고 있음
- 이외에도 화이자는 희귀병 및 유전병 연구에 대한 지속적인 관심을 기울이고 있으며 혁신적인 치료제 및 백신 개발을 추진하고 있음
- 2020년 3월 코로나19 바이러스로 인한 WHO의 공식 팬데믹 선언과 함께 화이자는 독일의 바이오엔텍과 공동으로
mRNA 백신 플랫폼을 활용한‘BNT162b2’백신을 신속하게 개발함. 이어 FDA 긴급 사용승인 후 추가 FDA 승인으로 화이자
백신이 출시되었으며, 전 세계적으로 빠른 백신 접종으로 팬데믹으로 인한 피해를 다소 억제할 수 있었음
- 화이자와 바이오엔텍이 개발한‘BNT162b2’는 코로나19 바이러스 스파이크 단백질의 항원 정보를 담은 mRNA 백신으로 숙주에게
백신 접종 시 코로나19 바이러스에 대한 강한 면역원성을 유도함
- 그러나, 최근 코로나19 바이러스에 대한 변종(Omicron/XBB.1.5.)이 출현하면서,
스파이크 단백질의 아미노산 서열에도 일부 변형이 발생하여 이로 인한 면역 회피작용으로 백신의 면역원성이 점차 감소하고 있음
- 현재 화이자는‘BNT162b2’백신 혹은 이를 응용한 백신 관련 특허 출원 및 추가
임상 연구를 통해 코로나19 바이러스의 변종을 표적으로 한 백신 연구를 활발히
진행하고 있음
Moderna
- Moderna는 지난 2010년 창립한 생명공학 기업으로, 새로운 수준의
mRNA(messenger RNA) 의약품 개발을 선도하고 있음
- mRNA 플랫폼을 활용한 다양한 감염성 적응증에 대한 백신을 개발하고 있으며, 특히 수두 대상포진 바이러스 백신(mRNA 1278), 거대세포 바이러스 백신(mRNA
1443), 앱스타인바 바이러스 백신(mRNA 1195), 지카바이러스 백신(mRNA 1893),
치쿤구니야 바이러스 백신(mRNA-1944, VAL-181388), 호흡기세포융합 바이러스
백신(mRNA-1345) 등을 개발 중이며, 대표적으로 코로나19 바이러스 백신
(mRNA-1273)을 개발함
-
모더나는 화이자 백신과 동일한 mRNA 플랫폼을 활용하여 국립알레르기·전염병 연구소(NIAID)와 공동으로‘mRNA-1273’백신을 개발함
-
모더나와 국립알레르기·전염병연구소(NIAID)에서 공동 개발한‘mRNA-1273’백신도 화이자 백신과 같이 코로나19 바이러스 스파이크 단백질의 항원 정보를
담은 mRNA 백신으로 숙주에게 백신 접종 시 코로나19 바이러스에 대한 강한 면역원성을 유도함
-
그러나, 최근 코로나19 바이러스에 대한 변종(Omicron/XBB.1.5.)이 출현하면서, 스파이크 단백질의 아미노산 서열에도 일부 변형이 발생하여 이로 인한
면역 회피 작용으로 백신의 면역원성이 점차 감소하고 있음
-
이에 모더나는 코로나19 바이러스의 변종에 대항할 수 있는 백신((예시‘스파이크박스2주’오미크론 BA.1-BA.4/5 변이 관련),
(‘스파이크박스 엑스주’XBB.1.5변이 관련)) 관련 특허 출원 및 임상 연구를 활발하게 진행하고 있음
Novavax
-
노바백스는 미국의 거대 생명공학 회사로 심각한 감염병에 대한 혁신적인 백신을 만드는 기업임
-
노바백스에서 개발한‘NVX-CoV2373’백신은 아단위(서브유닛) 백신으로 합성항원 백신 또는 재조합 단백질 백신이라고도 부르는데,
유전자재조합 방식으로 바이러스의 표면 항원 단백질만을 생산하여 주입하는 방식으로 코로나19 바이러스에 대한 면역원성을 유도함
-
구체적으로 코로나19 바이러스 스파이크 단백질을 항원으로 활용하여 아단위(서브유닛) 형태로 생산, 숙주에게 주입하여 면역원성을 유도함
-
백신 개발 후 초기에 노바백스 백신은 mRNA 백신과 대등한 예방률을 보였으나, 오미크론 등 변종의 출현으로 인해 기존의 백신만으로는 예방효과를 유지하는 데 어려움이 있음
-
이에 노바백스는 최근 유행하고 있는 변종(XBB.1.5, XBB1.16 및 XBB.2.3 등)에 면역반응을 유도할 수 있는 백신을 개발하는 등 변종 예방을 위한 백신 관련 특허
출원 및 임상 연구를 활발하게 진행하고 있음